Evolución clínica y análisis del estado del cartílago articular por mapeo-T2 y segunda vista artroscópica a veinticuatro meses del trasplante de menisco medial
Anell Olivos-Meza, Arturo Almazán Díaz, Socorro Cortés González, Roberto Sánchez, Clemente Ibarra, Francisco Cruz-López
RESUMEN
El objetivo de este trabajo es evaluar la evolución clínica, la condroprotección y la reacción inmunológica del trasplante de menisco (TM) con aloinjerto gama irradiado (GI) versus fresco congelado (FC) a veinticuatro meses. Veinte TM mediales en veinte pacientes, se evaluaron escalas de rodilla, Mapeo-T2 y segunda vista artroscópica, así como identificación de reacciones inmunológicas con la medición de citocinas inflamatorias por PCR en sangre y líquido sinovial.
Trece trasplantes con injerto FC y siete GI, edad promedio de treinta y dos años. Mejoría significativa en escalas a veinticuatro meses: KOOS (dolor 67.80/79.30; síntomas 60.80/82.10; AVD 8.05/92.40; deportes 37/63.35; CV 28.90/71.30), Lysholm (62.20/85.80), IKDCs (50.17/72.12), EVA (3.35/0.4). El cartílago del compartimento trasplantado se mantuvo dentro de valores normales, sin diferencia a los veinticuatro meses (fémur: 33.43 versus 33.50 ms, p = 0.16) (tibia: 33.57 versus 34.35 ms, p = 0.21). Todos los pacientes mostraron integridad del injerto a los doce meses en la segunda vista artroscópica. Solo se observó aumento en las citoquinas plasmáticas IL-6 e IL-17 en un paciente del grupo GI, sin repercusión clínica. Mejoría clínica, adecuada integración y condroprotección significativa a veinticuatro meses en ambos tipos de injertos.
Palabras Clave: Trasplante de Menisco; Aloinjerto de Menisco; Condroprotección; Reacción Inmunológica.
ABSTRACT
To evaluate the clinical course, chondroprotection and immunological reaction of meniscus transplantation (TM) with gamma irradiated (GI) versus fresh frozen (FC) allograft at twenty-four months. Twenty medial TMs in twenty patients, knee scales, T2-mapping and second arthroscopic view were evaluated, as well as identification of immunological reactions with the measurement of inflammatory cytokines by PCR in blood and synovial fluid.
Thirteen transplants with FC graft and seven GI grafts, average age of thirty-two years. Significant improvement on scales at twenty-four months: KOOS (pain 67.80 / 79.30; symptoms 60.80 / 82.10; AVD 8.05 / 92.40; sports 37 / 63.35; CV 28.90 / 71.30), Lysholm (62.20 / 85.80), IKDCs (50.17 / 72.12), EVA (3.35 / 0.4). The cartilage of the transplanted compartment remained within normal values, with no difference at twenty-four months (femur: 33.43 versus 33.50 ms, p = 0.16) (tibia: 33.57 versus 34.35 ms, p = 0.21). All patients showed integrity of the graft at twelve months in the second arthroscopic view. An increase in plasma cytokines IL-6 and IL-17 was only observed in one patient in the GI group, without clinical repercussion. Clinical improvement, adequate integration and significant chondroprotection at twenty-four months in both types of grafts.
Key Words: Meniscus Transplant; Meniscus Allograft; Chondroprotection; Immune Reaction.
INTRODUCCIÓN
Los efectos degenerativos de la meniscectomía son bien conocidos.1-11 Después de la resección del menisco se produce un aumento de las fuerzas de contacto del cartílago femoral y tibial, lo que conduce a un deterioro progresivo y el desarrollo de osteoartritis temprana. El síndrome postmenisectomía se puede presentar a corto o mediano plazo y los pacientes experimentan dolor severo, derrame articular y cierto grado de inestabilidad del compartimento afectado.12-17 El trasplante de menisco (TM) es una opción eficaz en pacientes con síntomas postmeniscectomía total, mejora los síntomas y la calidad de vida.18-19
De acuerdo con una revisión sistemática, tanto el compartimento medial como el lateral mejoran los síntomas de los pacientes con una tasa de falla de 10.6%.6 El trasplante con aloinjerto confiere un riesgo de rechazo y transmisión de enfermedades infecciosas, por lo que son sometidos a diferentes procesos de esterilización. Dentro de las técnicas que otorgan mejores resultados en la esterilización se encuentra la irradiación gamma en altas dosis. Sin embargo, aún se especula sobre la alteración en las propiedades biomecánicas y en el deterioro en la resistencia de los aloinjertos con este proceso. Algunos estudios han demostrado que las tensiones de contacto pico y el área de contacto total mejoran después del TM.20-22 No obstante, no hay reportes específicos que respalden su efecto condroprotector. El mapeo-T2 es uno de los mejores métodos para evaluar cuantitativamente los cambios en la composición y estructura del cartílago articular, lo que permite identificar si existe deterioro o indicios de osteoartritis temprana.23-26 Hoy en día, no hay un estudio en el que se describa la condroprotección del TM evaluado con mapeo-T2.
Los injertos de menisco se consideran tejidos inmunoprivilegiados, aunque algunas evaluaciones histológicas y bioquímicas han demostrado reacciones inmunológicas subclínicas presentadas como una respuesta humoral mediante la elevación de citocinas inflamatorias. Está bien documentado que las citocinas inflamatorias como la IL-1 y el FNT-alfa disminuyen con la reparación meniscal y trasplante meniscal. Sin embargo, no hay informes sobre marcadores inmunológicos relacionados con el TM.
El objetivo del siguiente estudio es evaluar los resultados clínicos, la condroprotección y la reacción inmunológica del trasplante de menisco (TM) con aloinjerto gama irradiado (GI) versus fresco congelado (FC) a veinticuatro meses.
MATERIALES Y MÉTODOS
Se realizaron veinte TM mediales con aloinjertos en diecinueve pacientes con diagnóstico de síndrome postmenisectomía, con una edad entre dieciocho y cincuenta y cinco años. Un paciente recibió trasplante en ambas rodillas. El estudio se realizó en el Instituto Nacional de Rehabilitación de la Ciudad de México y por un mismo cirujano. Fue registrado y aprobado por el comité de Ética e Investigación Institucional y todos los pacientes firmaron consentimiento informado. La evaluación clínica se efectuó con escalas de rodilla, escala visual análoga y exploración física, mientras que la condroprotección se analizó mediante el tiempo de relajación del agua reportado en el mapeo-T2 a los doce y veinticuatro meses.
A los doce meses del trasplante se realizó segunda vista artroscópica analizando integridad del injerto, presencia de rupturas, o fallas. Antes del procedimiento, y a los doce meses de seguimiento, se tomaron muestras de sangre y líquido sinovial en todos los pacientes para monitorear la actividad inmunológica sistémica e intraarticular. Los aloinjertos se obtuvieron de acuerdo con los estándares de la asociación de bancos de tejidos en México y se asignaron de acuerdo con la disponibilidad del tamaño más adecuado para cada paciente. Se utilizaron aloinjertos frescos congelados no irradiados (FC) del Banco de Tejidos de Monterrey, México, y gama irradiados (GI) protegidos con el método Clearant™ provenientes de Biograft de México (Banco de Tejidos Musculoesqueléticos y Piel).
Planificación preoperatoria
El tamaño del aloinjerto se obtuvo con el método de Pollard por tres observadores diferentes de donde se obtuvo la media de esos tres valores.23 Todos los pacientes se sometieron a un examen físico detallado y estudios de imagen (Rayos-x y RM) para identificar deformidad angular, inestabilidad u osteoartritis avanzada.
Técnica quirúrgica
Todos los procedimientos se efectuaron con anestesia regional, decúbito supino con uso de leg holder en la extremidad a intervenir (fig. 1). Se realizaron portales estándar (AM y AL) y una artroscopía diagnóstica de rutina para identificar y tratar las lesiones concomitantes. Se preparó el lecho meniscal resecando bordes en exceso y restos capsulares, dejando solo un remanente de 1 a 2 mm. Todos los trasplantes fueron mediales y se utilizó la técnica de doble pastilla ósea (fig. 2). Para realizar las perforaciones en la tibia se utilizó la guía tibial de reconstrucción de ligamento cruzado anterior para técnica all-inside (Arthex®, Naples, FL) y la broca de perforación flip cutter (Arthex®, Naples, FL) para realizar sockets de 9 mm de diámetro por 10 a 11 mm de profundidad. Una vez realizados los sockets, el portal medial se amplió 10 mm hacia distal para poder introducir el injerto como se describe en la técnica de Cruz-López y cols. (fig. 3)
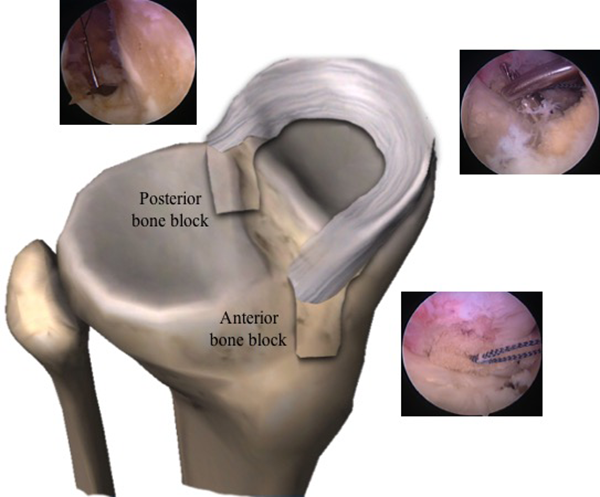
Figura 1: Posición para el trasplante de menisco medial artroscópico de rodilla derecha. El paciente se coloca en posición supina con el miembro pélvico a intervenir sujetado por un leg holder para permitir acceso a todos los compartimentos de la rodilla, mientras que la pierna contralateral se puede colocar sobre una piernera en abducción y rotación externa.
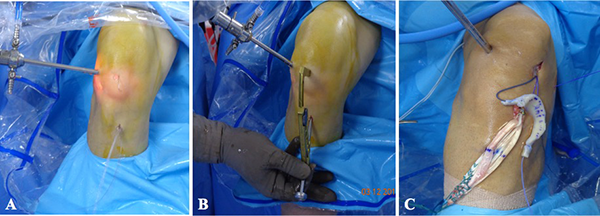
Figura 2: Esquema del trasplante de menisco medial en rodilla derecha con doble pastilla ósea. Para realizar las perforaciones en la tibia para cuerno posterior y cuerno anterior se utilizó la guía tibial de reconstrucción de ligamento cruzado anterior para técnica all-inside (Arthex®, Naples, FL) y la broca de perforación flip cutter (Arthex®, Naples, FL) para dejar sockets de 9 mm de diámetro por 10 a 11 mm de profundidad.
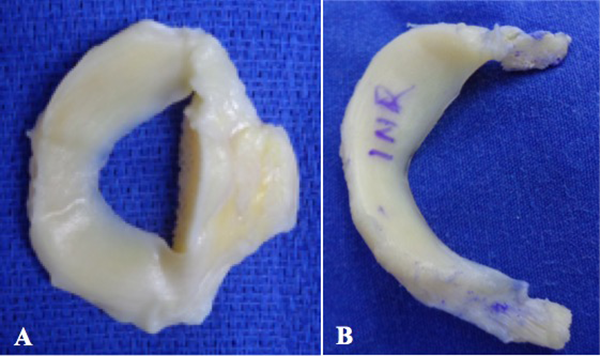
Figura 3: Trasplante de menisco medial en rodilla derecha. A) Portal anterolateral (AL) para visión y portal anteromedial (AM) para trabajo. B) Introducción de la guía tibial de reconstrucción de LCA por el portal AM para la realización del socket posterior. El socket anterior se realiza después de haber introducido la pastilla posterior y después de la sutura de del cuerno posterior y cuerpo, con esto se asegura la adecuada posición del socket anterior, según el tamaño del injerto. C) El portal AM se prolonga 10 mm hacia distal al introducir el injerto meniscal. En la imagen C, se observa la reconstrucción concomitante del LCA.
Preparación del aloinjerto
Antes de la preparación, el aloinjerto meniscal se sumergió en una solución salina estéril con gentamicina (160 mg) durante treinta minutos. El bloque de hueso se cortó y se moldearon los taquetes óseos del cuerno anterior y posterior a un diámetro de 8 mm por una longitud de 10 mm (fig. 4). En cada taquete óseo se colocó una sutura parcialmente absorbible de alta resistencia (OrthocordTM #1 DePuy Mytek, Raynham, MA) para facilitar la tracción dentro de los sockets.27
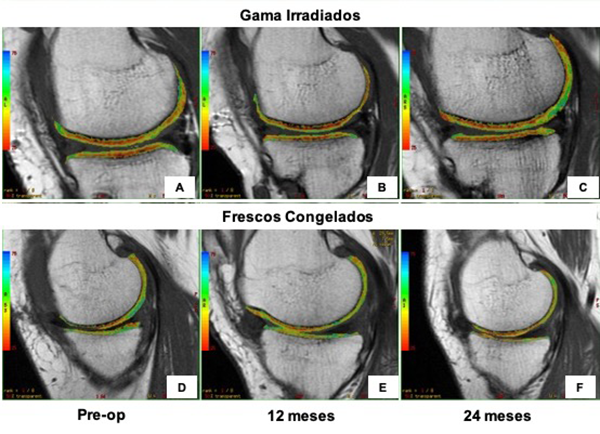
Figura 4: Preparación del injerto de menisco medial. A) El puente óseo con el que se otorga el menisco medial por el Banco de tejidos se remodela para dejar solo dos pastillas óseas. B) Se dejan las pastillas óseas para cada cuerno con un diámetro de 9 mm por una longitud de 10 mm. Es importante marcar la cara superior del menisco para evitar confusiones, así como el cuerno anterior y posterior antes de cortar los taquetes.
Rehabilitación postoperatoria
Se difirió el apoyo durante cuatro semanas, a la quinta, se inició apoyo parcial del 40% del peso corporal y para la sexta semana el paciente tenía apoyo total. La movilidad se inició al día siguiente de la cirugía de 0 a 30°, progresando 30° cada dos semanas hasta lograr un rango completo de 130° a la sexta semana. A partir del tercer mes se inició un programa de reacondicionamiento muscular sobre la base de evaluaciones isocinéticas cada seis semanas, tomando como control la rodilla contralateral. Una vez alcanzada la fuerza muscular de un 90% con respecto a la no operada, se les permitió inicio de actividades físicas.
Escalas clínicas
La evaluación clínica se realizó aplicando escalas validadas de rodilla antes y después de la cirugía (tres, seis, doce y veinticuatro meses) utilizando: IKDC subjetivo, Lysholm, Kujala, KOOS, Tegner y Escala Visual Análoga (EVA).
Evaluación de la condroprotección por mapeo-T2
La resonancia magnética (RM) se realizó en un resonador de 1.5 Tesla (SignA-Horizon HDX GE, Med Rad, Milwaukee, EE. UU.). Después de obtener las imágenes de mapeo-T2 (Cartigram™) en el plano sagital, se procesaron en la estación de trabajo (Windows® Advantage, General Electric) por dos expertos en RM. Se midieron dos regiones de interés (ROI = Region of Interest, por sus siglas en inglés) seleccionando la zona de carga del cartílago del cóndilo femoral (ROI-CF) y la zona de carga del cartílago del platillo tibial (ROI-PT) para obtener el tiempo de relajación del agua en milisegundos a los tres, seis, doce y veinticuatro meses.
Segunda vista artroscópica
Se hizo en todos los pacientes a los doce meses. Se evalúo la superficie articular, lesiones concomitantes tratadas y el estado de los injertos (integración, rupturas o lesiones).
Evaluación inmunológica
Las muestras de sangre y líquido sinovial se tomaron antes de la cirugía y se almacenaron a -80° C para ser procesadas en conjunto en un mismo kit de ELISA (Preprotech Inc. Rocky Hill, NJ, EE. UU.). Se analizó la muestra en un espectrofotómetro con una longitud de onda de 450 nm. El control de los valores de las citoquinas se tomó de algunos pacientes sanos (sin lesiones articulares evidenciadas por exploración física, rayos-x o RM).
RESULTADOS
Trece aloinjertos FC y 7 GI se trasplantaron en diecinueve pacientes. La edad media fue de 32.33 años (rango 22-45) con un seguimiento promedio de veinticuatro meses. Todos los sujetos fueron masculinos con un IMC promedio de 26.1. Doce pacientes tuvieron ruptura del LCA reconstruidos en el mismo procedimiento; tres con lesión de cartílago (ICRS-4) con un tamaño promedio de 28.75 mm en el cóndilo femoral medial (tratados con traslado osteocondral) (Tabla 1).
TABLA 1. DATOS DEMOGRÁFICOS
|
Injerto |
N |
Edad |
Derecha |
Izquierda |
Ruptura LCA |
Lesión de Cartílago |
GI |
7 |
31.1 ± 5.40 |
3 |
4 |
4 |
1 |
FC |
13 |
33.0 ± 8.22 |
5 |
8 |
8 |
2 |
Total |
20 |
|
8 |
12 |
12 |
3 |
Injertos gama irradiados versus frescos congelados.
Escalas clínicas
Todos los pacientes mejoraron en todas las escalas en comparación con los valores preoperatorios (Tabla 2). Se utilizó una prueba t de Student para grupos emparejados (SPSS v18 para Windows®, Chicago, IL) con p = 0.05.
TABLA 2. MEJORÍA EN EVOLUCIÓN CLÍNICA
|
Escala |
Pre-op |
Veinticuatro meses |
p |
KOOS-Dolor |
67.80 |
79.30 |
>0.05 |
KOOS-Síntomas |
60.80 |
82.10 |
KOOS-AVD |
78.05 |
92.40 |
KOOS-Deportes |
37.0 |
63.35 |
KOOS-Calidad de vida |
28.90 |
71.30 |
Lysholm |
62.20 |
85.80 |
IKDC-subjetivo |
50.17 |
72.12 |
EVA |
3.35 |
0.45 |
SF-36 Físico |
67.80 |
79.30 |
SF-36 Mental |
45.20 |
54.85 |
Pre-op versus veinticuatro meses. Todos los pacientes mejoraron en todas las escalas clínicas, sin haberse observado diferencia significativa entre los injertos GI y FC (p >0.05).
Hallazgos en resonancia magnética
A los veinticuatro meses de seguimiento se evalúo la extrusión meniscal por RM y se encontró 3.42 mm de extrusión con un porcentaje promedio del 35.38% (10.32-70.85%). La extrusión se consideró como mínima si era < o = 3 mm y como considerable si era >3 mm. Doce aloinjertos tuvieron una extrusión considerable y ocho una extrusión mínima. Las lesiones de cartílago reparadas con traslado osteocondral mostraron una integración completa de los taquetes con características normales en la superficie articular, e integración al tejido adyacente con un MOCART de 95.
Evaluación del mapeo-T2
El tiempo de relajación (TR) en el mapeo-t2 incrementó tanto en el cóndilo femoral como en el platillo tibial progresivamente hasta los veinticuatro meses en ambos tipos de injertos (Tabla 3). Aunque el incremento fue evidente en los pacientes con fresco congelado (fémur 2.6 ms, tibia 3.36 ms) comparado con los gama irradiados (fémur 1.39 ms, tibia 0.06 ms), la diferencia entre grupos no fue significativa en ninguna de las mediciones (Tabla 4) (fig. 5).
TABLA 3. ESTADO DEL CARTÍLAGO A VEINTICUATRO MESES DEL TRASPLANTE (MAPEO-T2)
|
Zona |
Pre-op |
Doce meses |
Veinticuatro meses |
Incremento |
Cóndilo femoral |
35.41 ± 5.32 |
37.37 ± 6.41 |
38.47 ± 5.67 |
3.06 ms |
P |
0.110 |
0.098 |
Platillo tibial |
36.55 ± 7.21 |
34.33 ± 5.07 |
38.47 ± 5.39 |
1.92 ms |
p |
0.4881 |
0.169 |
Evaluación de los cambios en el tiempo de relajación a veinticuatro meses en los veinte pacientes estudiados. Se observó un incremento sostenido a través del tiempo comparado con los valores preoperatorios, tanto en fémur como en tibia. Sin embargo, no hubo diferencia significativa y los valores del tiempo de relajación aún se encuentran en el rango de cartílago “no osteoartrítico” (25-45 ms).
TABLA 4. TIEMPO DE RELAJACIÓN DEL AGUA EN EL MAPEO-T2 (GI VERSUS FC)
|
|
Zona e Injerto |
Pre-op |
Doce meses |
Veinticuatro meses |
Incremento GI |
Incremento FC |
Cóndilo femoral
(GI vs FC) |
34.60 vs 36.08 |
35.92 vs 38.58 |
35.99 vs 38.68 |
1.39 ms |
2.6 ms |
p |
0.692 |
0.210 |
0.479 |
Diferencia = 1.2 ms |
Platillo tibial
(GI vs FC) |
36.50 vs 36.59 |
35.58 vs 33.07 |
36.56 vs 39.95 |
0.06 ms |
3.36 ms |
p |
0.468 |
0.365 |
0.223 |
Diferencia = 3.3 ms |
No se encontró diferencia significativa entre los tipos de injerto en el análisis del tiempo de relajación del agua, tanto en cóndilo femoral como en el platillo tibial a los veinticuatro meses de seguimiento. Aunque el incremento en milisegundos fue mínimo, este fue mayor en los pacientes con injerto FC versus GI en ambas superficies articulares (fémur y tibia).
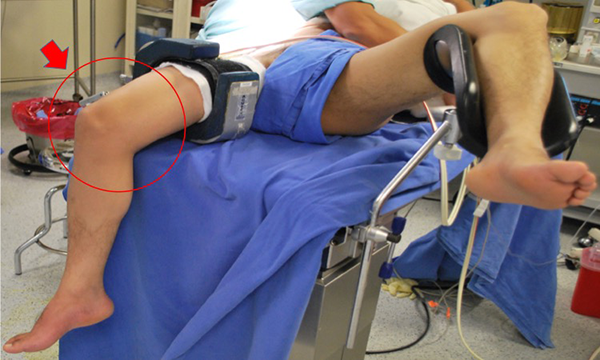
Figura 5: Medición del tiempo de relajación (TR) del agua en el cóndilo femoral y meseta tibial mediante mapeo-T2. El TR incrementó tanto en el cóndilo femoral como en el platillo tibial progresivamente hasta los veinticuatro meses en ambos injertos (GI y FC). Aunque el incremento fue evidente en los pacientes con fresco congelado (fémur 2.6 ms, tibia 3.36 ms). A, B y C) Comparado con los gama irradiados (fémur 1.39 ms, tibia 0.06 ms). D, E y F) La diferencia entre grupos no fue significativa en ninguna de las mediciones.
Evaluación de aloinjertos FC versus GI
Se compararon todos los resultados entre el uso de un fresco congelado y un aloinjerto de Clearant™ con una prueba t de Student para grupos no pareados. Solo el grado de extrusión se incrementó significativamente en los FC, el tiempo de relajación y los resultados clínicos no mostraron alteraciones.
Segunda vista artroscópica
Se realizaron segundas vistas a los diecinueve pacientes trasplantados. Se evaluó la integridad del injerto, cicatrización al lecho meniscal, consistencia y presencia de lesiones condrales en el compartimento trasplantado. En los dos primeros pacientes se observaron pequeñas lesiones en la zona blanca-blanca donde se había colocado la sutura de tracción (unión de cuerno posterior y cuerpo). Un paciente mostró una integración parcial del cuerno anterior, esto no modificó los resultados clínicos. Se advirtió la integración total de los traslados osteocondrales sin presencia de nuevas lesiones o alteraciones en la zona reparada. El cartílago del fémur y la tibia del compartimento medial no tuvo cambios visibles ni alteraciones estructurales a la palpación, como reblandecimiento o fisuras en los pacientes que no tenían lesión condral previa.
Resultados inmunológicos
Se analizó la presencia de citocinas (IL-1B, IL-6, IL-17A, IF-γ, FNT-α) en diez pacientes antes de la cirugía y a los doce meses del postoperatorio (ANOVA y Tukey post-hoc). Cinco pacientes tenían niveles elevados de al menos 3 citoquinas. Uno GI y 4 FC, ninguno de ellos tenía niveles elevados de IF-γ. Se realizó una correlación entre los resultados clínicos de la escala de Lysholm, el grado de extrusión meniscal y el tiempo de relajación del agua en los pacientes con 3 citocinas elevadas para determinar si su aumento se relacionaba con alteraciones en la función y en el deterioro del cartílago articular. Sin embargo, solo se encontró una correlación estadísticamente significativa (p <0.05) con el grado de extrusión, sin que esto haya influido en la evolución clínica o el deterioro del cartílago a doce meses del trasplante.
DISCUSIÓN
El trasplante de aloinjerto meniscal es un procedimiento bien establecido que hoy en día se realiza en todo el mundo. El principio de la utilización de injertos frescos congelados siempre estuvo orientado a que el implante meniscal preservara el mayor número de células viables, lo que podría mejorar la producción de matriz extracelular y la integración del injerto al lecho perimeniscal, comparado con el uso de aloinjertos gama irradiados. Sin embargo, Arnoczky1 rechazó esta teoría cuando observó que al final de la primera semana, las células del injerto fresco congelado desaparecían y el menisco empezaba a ser repoblado por las células del huésped.
El uso de aloinjertos esterilizados por radiación gama siempre ha sido reservado debido a la preocupación de que esta técnica elimine las células del implante y además altere su biomecánica por variación en la estructura de colágeno.28 Cameron y cols. reportaron de uno a cinco años de buenos a excelentes resultados con injertos gama irradiados, sin embargo, en su método de esterilización no se menciona el uso de alguna sustancia radioprotectora para evitar daño a la estructura del tejido, como el tratamiento de los injertos manejados con método Clearant™ utilizados en nuestro estudio. Por otro lado, Verdonk29 también reportó el uso de aloinjertos gama irradiados con una tasa de fallas del 44%, lo cual no solo se puede atribuir al tipo de injerto sino a otros factores muy diversos (lesiones concomitantes, IMC elevado, mala alineación, cálculo inadecuado del tamaño del injerto, inadecuada técnica quirúrgica).
En cuanto al efecto protector proporcionado por el trasplante de menisco no hay estudios que evalúan cuantitativamente el estado del cartílago articular del compartimento afectado mediante mapeo-T2. Verdonk y cols. reportaron un seguimiento a diez años de pacientes con trasplante de menisco utilizando aloinjertos frescos congelados: solo el 35% de los pacientes se mantuvo sin cambios en el cartílago del compartimento trasplantado.30 Sin embargo, en este estudio, el análisis del compartimento fue mediante radiografías y segunda vista artroscópica, no hay comparabilidad con nuestro estudio debido a que el mapeo-T2 da un reporte cuantitativo de la estructura del cartílago articular que puede prever deterioro incipiente que aún no se refleja radiográficamente ni macroscópicamente. Además, la segunda vista es un estudio invasivo que no es fácil de realizar como una medida de seguimiento continuo a todos los pacientes.
Por otro lado, Kelly y cols. realizaron un estudio en ovejas comparando los cambios en el estado del cartílago articular de las rodillas postmenisectomizadas versus las trasplantadas a cuatro meses de seguimiento por mapeo-T2: las rodillas con trasplante de menisco se mantuvieron sin cambios en el cartílago articular, mientras que las rodillas postmenisectomizadas tuvieron un deterioro significativo del cartílago articular.31
En nuestro estudio se observó que a veinticuatro meses de trasplantados el tiempo de relajación del agua del cartílago del compartimento medial se mantiene sin cambios significativos con respecto al valor inicial (tres meses), lo cual es un resultado alentador en cuanto a la condroprotección ofrecida por el trasplante de menisco. Una de las debilidades de este estudio es el no contar con valores prequirúrgicos del mapeo-T2, ni con controles de rodillas sanas donde el menisco siga intacto en estructura y función y se puedan determinar los cambios del estado del cartílago articular con el paso de los años, y así compararlos con la evolución del paciente con menisco trasplantado, ya que es bien sabido que con el paso del tiempo el cartílago sufre cambios y deterioros en su estructura y composición inherentes a la edad.
CONCLUSIÓN
Los resultados clínicos presentan una mejoría significativa a veinticuatro meses sin diferencia relevante entre los injertos GI y los FC. No hubo deterioro significativo en el estado del cartílago articular del compartimento medial a veinticuatro meses del trasplante con ningún tipo de injerto. Aunque existe “respuesta inmunológica” después del trasplante, ya sea con injerto fresco congelado o gama irradiado, esta elevación no es suficiente para ser considerada como un marcador de rechazo ya que esto no influyó en los resultados clínicos ni de condroprotección.
AGRADECIMIENTOS
Este trabajo fue apoyado por el Consejo Nacional de Ciencia y Tecnología (Salud 202051 y Salud 2007 C01-68969). Los autores desean agradecer especialmente al Banco de Tejidos Musculoesqueléticos y Piel Biograft de México por la donación de los injertos Gama Irradiados con el Método Clearant™ y a las enfermeras del Servicio de Ortopedia del Deporte y Artroscopia del Instituto Nacional de Rehabilitación "Luis Guillermo Ibarra Ibarra": Ivonne Trigueros-Anaya, Gloria González-Vellano, Montserrat Gabriela Romero Lobera, Ana María Godínez-Monroy y Carmen González-Vellano por su asistencia en la realización de los procedimientos quirúrgicos.
BIBLIOGRAFÍA
1. Arnoczky SP; DiCarlo EF; O ’Brien SJ; Warren RF. Cellular repopulation of deep-frozen meniscal autografts: an experimental study in the dog. Arthroscopy, 1992; 8: 428–36.
2. Cameron JC; Saha S. Meniscal allograft transplantation for unicompartmental arthritis of the knee. Clin Orthop, 1997; 337: 164-71.
3. Conway B; Tomford W; Mankin HJ; Hirsch MS; Schooley RT. Radiosensitivity of HIV-I: potential application to sterilization of bone allografts. AIDS, 1991; 5: 608–9.
4. McDermott ID; Amis AA. The consequences of meniscectomy. J Bone Joint Surg Br, 2006; 88-B(12): 1549-56.
5. Fairbank TJ. Knee joint changes after meniscectomy. J Bone Joint Surg Br, 1948; 30: 664-70.
6. Hamlet W; Liu SH; Yang R. Destruction of a cryopreserved meniscal allograft: a case for acute rejection. Arthroscopy, 1997; 13: 517.
7. Heard BJ; et al. Early joint tissue changes are highly correlated with a set of inflammatory and degradative synovial biomarkers after ACL autograft and its sham surgery in an ovine model. J Orthopaedic Research, 2011; 29: 1185-92.
8. Jackson DW; Windler GE; Simon TM. lntraarticular reaction associated with the use of freeze-dried, ethylene oxide-sterilized bone-patella tendon-bone allografts in the reconstruction of the anterior cruciate ligament. Am J Sports Med, 1990; 18: 1-10.
9. Jazrawi L; Alaia M; Chang G; Fitzgerald E; Recht M. Advances in magnetic resonance imaging of articular cartilage. J Am Acad Orthop Surg, 2011; 19: 420-9.
10. Johnson RJ; Kettelkamp DB; Clark W. Factors affecting late results after meniscectomy. J Bone Joint Surg Am, 1974; 56: 719-29.
11. Frank WR; Kent K; Hannon M; Hunter D; Eckstein F; et al. Partial meniscectomy is associated with increased risk of incident radiographic osteoarthritis and worsening cartilage damage in the following year. Eur Radiol, 2017; 27(1): 404–13.
12. Fox MG. MRI Imaging of the meniscus: review, current trends, and clinical implications. Radiol Clin North Am, 2007; 15(1): 1033-53.
13. Englund M; Guermazi A; Gale D; Hunter DJ; Aliabadi P; Clancy M; et al. Incidental meniscal findings on knee MRI in middle-aged and eldery persons. N Eng J Med, 2008, 359(11): 1108-15.
14. Monllau JC; González-Lucena G; Gelber P; Pelfort X. Meniscus transplantation: a current review. Techniques in Knee Surg, 2010; 9(2): 107-13.
15. Dandy DJ; Jackson DW. Meniscectomy and chondromalacia of femoral condyle. J Bone Joint Surg Am, 1975; 57: 116-9.
16. Sihvonen R; Paavola M; Malmivaara A; Itälä A; Joukainen A; et al. Arthroscopic partial meniscectomy versus placebo surgery for a degenerative meniscus tear: a 2-year follow-up of the randomised controlled trial. Ann Rheum Dis, 2018; 77: 188-95.
17. Tapper EM; Hoover NW. Late results after meniscectomy. J Bone Joint Surg Am, 1969; 51: 517-26.
18. Noyes FR; Barber-Westin SD; Rankin M. Meniscal transplantation in symptomatic patients less than fifty years old. J Bone Joint Surg, 2004; 86(7): 1392-404.
19. Jones RE; Smith EC; Reisch JS. Effects of medial meniscectomy in patients older than forty years. J Bone Joint Surg Am, 1978; 60: 783-6
20. Paletta GA Jr; Manning T; Snell E; Parker R; Bergfeld J. The effect of allograft meniscal replacement on intra-articular contact area and pressures in the human knee. A biomechanical study. Am J Sports Med, 1997; 25: 692–8.
21. Huang A; Hull ML; Howell SM. The level of compressive load affects conclusions from statistical analyses to determine whether a lateral meniscal autograft restores tibial contact pressure to normal: a study in human cadaveric knees. J Orthop Res, 2003; 21: 459–64.
22. Alhalki MM; Hull ML; Howell SM. Contact mechanics of the medial tibial plateau after implantation of a medial meniscal allograft: a human cadaveric study. Am J Sports Med, 2000; 28: 370–6.
23. Pollard ME; Kang Q; Berg EE. Radiographic sizing for meniscal transplantation. Arthroscopy, 1995; 11: 684-7.
24. Riera KM; Rothfusz NE; Wilusz RE; Weinberg JB; Guilak F; Mcnulty AL. Transforming growth factor-beta 1 and integrative meniscal repair : influences on meniscal cell proliferation and migration. Arthritis Res Ther, 2011; 13: 187.
25. Rodeo SA; Seneviratne A; Suzuki K; et al. Histological analysis of human meniscal allografts. A preliminary report. J Bone Joint Surg Am, 2000; 82: 1071-82.
26. Scanzello; CR; et al. Synovial inflammation in patients undergoing arthroscopic meniscectomy: molecular characterization and relationship to symptoms. Arthritis Rheum, 2011; 63: 391-400.
27. Cruz-López F; Olivos-Meza A; Llano-Rodríguez LT; Ibarra C. Arthroscopic meniscal transplantation technique. J Sports Med Doping Stud, 2015; 6(1): 1-4.
28. Van Arkel ER; De Boer HH. Human meniscal transplantation. Preliminary results at 2 to 5-year follow-up. J Bone Joint Surg Br, 1995; 77: 589-95.
29. Verdonk P; Depaepe Y; Desmyter S; et al. Normal and transplanted lateral knee menisci: Evaluation of extrusion using magnetic resonance imaging and ultrasound. KSSTA, 2004; 12: 411-9.
30. Verdonk PC; Demurie A; Almqvist KF; Veys EM; Verbruggen G; Verdonk R. Transplantation of viable meniscal allograft. Survivorship analysis and clinical outcome of one hundred cases. J Bone J Surg Am, 2005; 87: 715-24.
31. Kelly BT; Potter HG; Deng XH; Pearle AD; Turner AS; Warren RF; Rodeo S. Meniscal allograft transplantation in the sheep knee: evaluation of chondroprotective effects. Am J Sports Med, 2002; 34: 1464-77.