ARTROSCOPIA | VOL. 27, N° 2: 78-87 | 2020
NOTA TÉCNICA
Cirugía de Revisión de Reconstrucción de Ligamento Cruzado Anterior en 2 Tiempos Quirúrgicos: Indicaciones, Descripción de Técnica Quirúrgica y Análisis de la Literatura
Claudio Mingo Saluzzi
Sanatorio Mater Dei. C.A.B.A., Argentina
Instituto Dupuytren. C.A.B.A., Argentina
RESUMEN
La cirugía de revisión del ligamento cruzado anterior (LCA) plantea una serie de dificultades específicas. Estas incluyen la falta de masa ósea para permitir la fijación efectiva de la reconstrucción, morbilidad de la zona del donante cuando se utiliza autoinjerto óseo para llenar los túneles, etc. Para abordar algunos de estos problemas, describimos una técnica de revisión de 2 etapas que utiliza aloinjerto óseo para el llenado del túnel y el autoinjerto de tendón rotuliano (HTH) para la reconstrucción del LCA. Además, la intervención incluye una fase extraarticular en la que el ligamento anterolateral se refuerza con una tenodesis para aumentar la estabilidad rotacional de la rodilla, mejorando así las posibilidades de éxito.
Tipo de Trabajo: Técnica Quirúrgica
Nivel Evidencia: V
Palabras clave: Revisión LCA; Injerto; Túneles; 2 Tiempos
ABSTRACT
Anterior cruciate ligament (ACL) revision surgery poses a number of specific difficulties. These include the lack of bone mass to enable effective fixation of the reconstruction, morbidity of the donor area when bone autograft is used to fill the tunnels .To address all these problems, we describe a 2-stage revision technique that uses bone allograft for tunnel filling and patellar tendon autograft (BTB) for ligament reconstruction. In addition, the intervention includes an extra-articular phase in which the anterolateral ligament is reinforced to increase the rotational stability of the knee, thus improving the prognosis of operation.
Type of Study: Surgical Technique.
Level of Evidence: V
Key Words: Revision ACL; Graft; Tunnel; 2 Stage
Claudio Mingo Saluzzi
claudiomingo@gmail.com
Recibido: Abril de 2020. Aceptado: Mayo de 2020.
INTRODUCCIÓN
La cirugía de revisión del Ligamento cruzado anterior (LCA) es una cirugía compleja, especialmente en los casos de déficit del stock óseo. Las dificultades aparecen cuando la orientación y el ensanchamiento de los túneles previos interfieren en la correcta colocación y posicionamiento de los nuevos túneles.1
La técnica quirúrgica consiste en la realización de los nuevos túneles en forma divergente sin comprometer la posición anatómica del nuevo ligamento ni la fijación del mismo.2,3
La revisión en un tiempo muchas veces es posible, pero a veces es necesario diferir el procedimiento y hacerlo en dos tiempos quirúrgicos, el primero para rellenar los túneles con injerto óseo y el segundo para la colocación del injerto de ligamento una vez recuperado la cantidad y calidad de la masa ósea del hueso receptor.
La cirugía en dos tiempos quirúrgicos tiene algunas desventajas. Los pacientes requieren más tiempo para su recuperación definitiva y la demora en la reconstrucción está asociada a mayor incidencia de artrosis y lesiones meniscales.4
Por eso la cirugía en dos tiempos está reservada únicamente en los casos en que las condiciones previas obligan a una posición sub óptima de los túneles, de la fijación o en los escenarios desfavorables para la respuesta biológica de incorporación del neoligamento.5-8
La técnica que utilizamos consiste en un primer tiempo de relleno de los túneles con aloinjerto óseo molido y la realización de una tenodesis extraarticular tipo Lemaire modificada para control rotacional, y en un segundo tiempo la realización de la plástica intraarticular definitiva 6 meses después de la confirmación de la incorporación de los injertos óseos en los túneles.
DESCRIPCIÓN DE CASO
Paciente del sexo masculino 28 años de edad con antecedente de cirugía de LCA hace 2 años con injerto de STRI y una fijación interferencial. Presentó varios episodios de inestabilidad, el último hace 35 días, consultando por inestabilidad clínica, dolor e impotencia funcional.
Al examen físico presento, prueba de Lachman positiva, maniobra de cajón anterior positivo y test del pivote positivo intenso 3X. Ausencia de otras lesiones ligamentarias mediales laterales o posteriores evidenciables en el examen físico inicial. Se solicitaron radiografías simples en posición de frente, perfil y axial que mostraron la ausencia de elementos de fijación metálicos y un ensanchamiento de ambos túneles femoral y tibial (fig. 1).
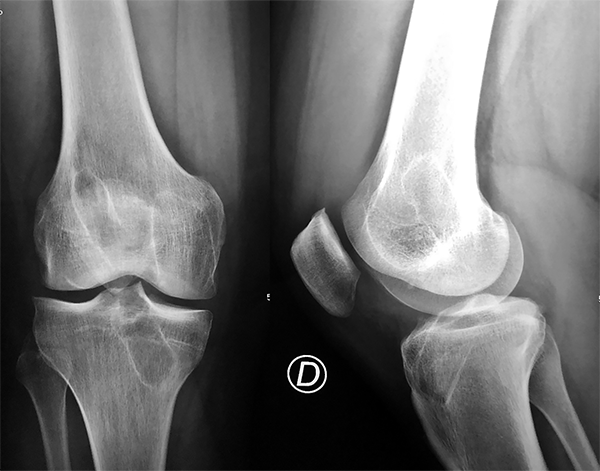
Figura 1: Rx preoperatorias donde se observa el ensanchamiento y posición de los túneles de la primera cirugía de reconstrucción.
La Resonancia Magnética Nuclear (RMN) evidencio la ruptura del neoligamento de LCA, imágenes hiperintensas en T2 en los túneles con agrandamientos de los mismos (fig. 2).
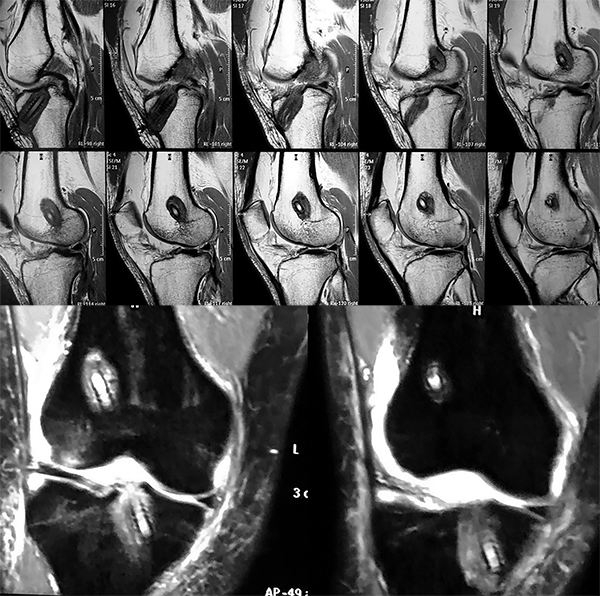
Figura 2: RMN preoperatoria donde se visualizan material de fijación y señal hiperintensa en los túneles.
Dado el ensanchamiento observado de los túneles se solicita una TAC con medición de los mismos (fig. 3).
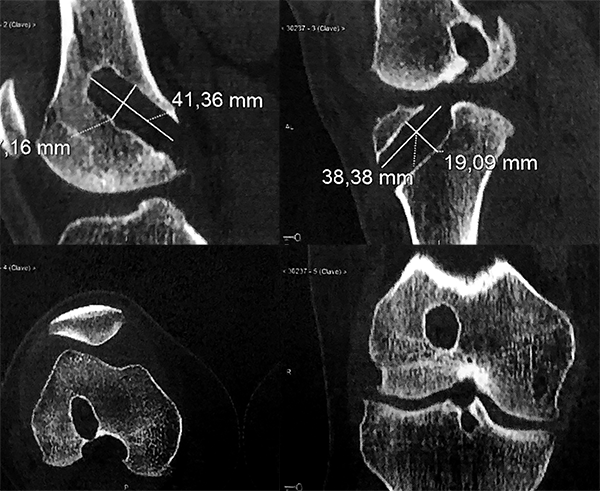
Figura 3: Medición preoperatoria en TAC. Ensanchamiento de los túneles femorales y tibiales en el plano frontal y sagital.
Luego de evaluar el caso y las posibilidades quirúrgicas, se llegó a la conclusión que la posición de los túneles y su tamaño comprometían la posición y fijación de la nueva plástica ligamentaria, decidiéndose realizar la revisión en 2 tiempos quirúrgicos.
Técnica Quirúrgica
Primer tiempo lavado articular y relleno de los túneles.
El paciente se posiciona en decúbito dorsal con manguito hemostático en la raíz del muslo, un soporte lateral y un realce en la parte distal de la camilla, que permite que el paciente se mantenga en posición aún anestesiado y sin ayuda externa en 90 y 120 grados de flexión de la rodilla (fig. 4).
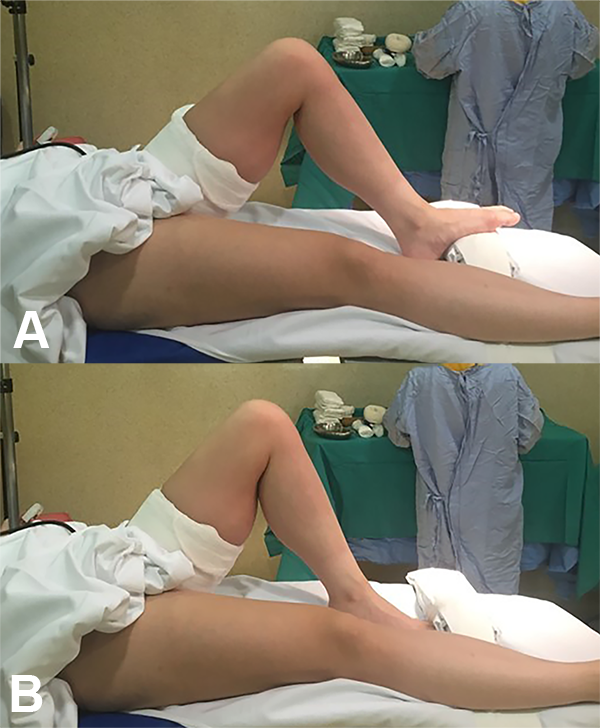
Figura 4: Posición del paciente.
Se realiza anestesia espinal y se repiten nuevamente las maniobras clínicas bajo anestesia a fin de confirmar la inestabilidad anterior y descartar otras agregadas.
Se realizan los portales artroscópicos clásicos medial y lateral para el lavado y desbridamiento articular, poniendo especial énfasis en el tratamiento de las lesiones condrales y meniscales, realizando en este caso meniscoplastia medial, condroplastia y sinovectomía parcial. Con instrumental motorizado y manual se realiza el debridamiento y limpieza de los túneles sacando todo tejido fibroso y materiales de fijación previo (fig. 5).
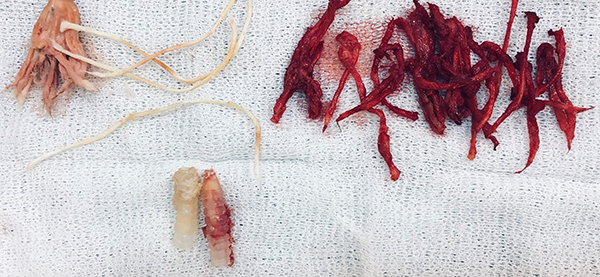
Figura 5: Extracción de material de los túneles.
Con el uso de portales accesorios y modificando el ángulo de flexión de la rodilla logramos llegar a la máxima visualización y limpieza de los túneles. Se busca obtener un lecho óseo esponjoso y sangrante para facilitar la incorporación del injerto, agrandando los mismos 1 mm. No se utilizó electro bisturí bajo agua ni radiofrecuencia para evitar la necrosis térmica.
Para el relleno de los túneles se utilizó aloinjerto molido cortico esponjoso pequeño, evitando así la morbilidad de la zona dadora del autoinjerto.
El injerto se lava y se desgrasa en solución fisiológica con antibiótico (vancomicina) para disminuir su viscosidad y mejorar su compactación. Para introducirlo en la articulación y rellenar el túnel femoral, se utilizó el set de injerto osteocondral de diferentes medidas y jeringas de plástico estéril de 3 y 5 mm. donde se decapitó la punta y se rellenó con el injerto molido bien compactado. Luego por portales habituales o accesorios ligeramente ampliados y/o pequeñas artrotomías se introdujeron en el túnel femoral (fig. 6).
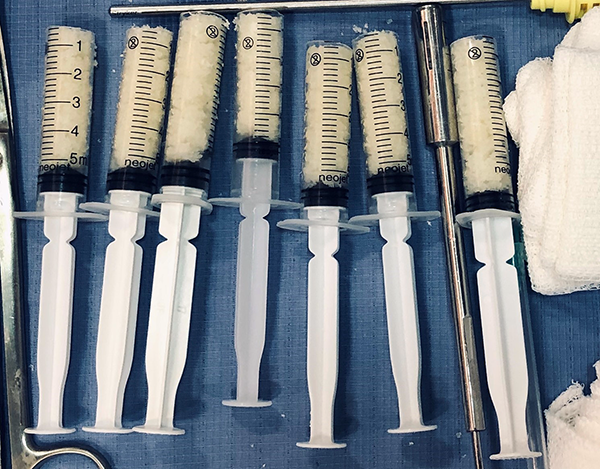
Figura 6: Injerto e instrumental para relleno de túneles.
Para la compactación se utilizó el instrumental del set osteocondral y los medidores de impingement del instrumental de la caja de LCA de diferentes diámetros.7-11
Este procedimiento se realizó lavando repetidamente la articulación. El injerto debe ser introducido estando bien compacto en las jeringas, y debe ser impactado fuertemente para evitar que se pierda en la articulación.
Para relleno del túnel tibial se realizó una pequeña incisión en la cara anterior de la tibia, localizando el túnel y realizando la limpieza y extracción del material de fijación previo y de las partes blandas. En la tibia el relleno es más simple, se realizó de distal a proximal con una cureta colocada en la salida articular del túnel tibial, obliterando la articulación para mejorar la compactación y evitar el pasaje a la misma.
Finalizado el procedimiento intraarticular, se realizo una tenodesis extraarticular tipo Lemaire modificada. Realizandó una incisión oblicua desde el epicóndilo lateral hasta el tubérculo de Gerdy, de aproximadamente 4 cm, se extrae una lonja de fascia lata de 1 cm de ancho, siguiendo las fibras de la misma y dejando 5 mm a posterior para facilitar el cierre. Se deja insertada a distal en el tubérculo de Gerdy, y se pasa por debajo del Ligamento lateral Externo (LLE) y el tendón del poplíteo, luego se libera la cortical externa del fémur 1 cm por encima y posterior del epicóndilo lateral y se coloca un arpón doble sutura de 5.5 mm, y se fija en 45 grados de flexión y rotación neutra, suturando el excedente sobre sí mismo en dirección al tubérculo de Gerdy (fig. 7).
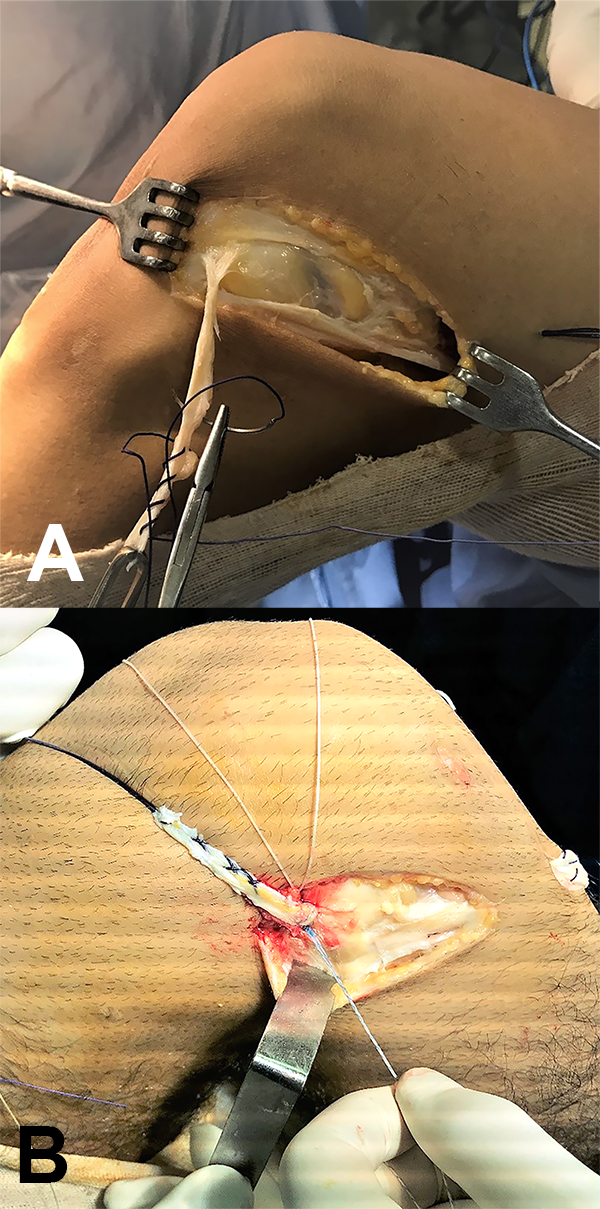
Figura 7: Tenodesis extraarticular de Lemaire modificada.
Protocolo entre el primer y segundo tiempo
Se inmoviliza y protege la rodilla con una férula en extensión por 2 semanas. Se permite la carga leve o parcial durante estas dos primeras semanas. Según tolerancia, estimulamos los ejercicios de movilidad a partir de la segunda semana, tratando de recuperar el arco de movilidad articular. Se retira todo apoyo externo a partir de la tercera semana. Permitiendo la realización de actividades suaves sin pivoteo a partir del 2 mes (bicicleta, musculación, actividades en el agua).
A partir de la 4to mes se evalúa al paciente para valorar si está en condiciones del segundo tiempo operatorio.
Los criterios desde el punto de vista clínico son movilidad completa, sin dolor en actividades de la vida diaria, sin derrame articular y trofismo muscular en desarrollo. En ese momento se solicitaron radiografías simples para evaluar la incorporación ósea (fig. 8).
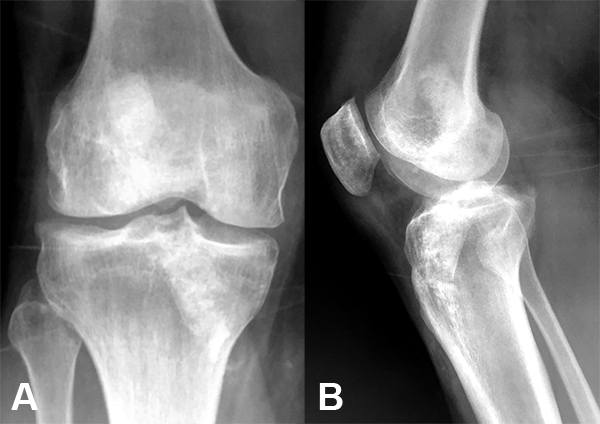
Figura 8: Rx postoperatoria.
Las mismas mostraron un relleno de los mismos, moteado por las características del injerto implantado, pero con una densidad similar al hueso circundante. El estudio para la toma de decisión final se completa con una tomografía computada donde se evaluó también el relleno óseo (fig. 9).
Con los requisitos clínicos completos, y una RX y TAC con densidad ósea satisfactoria se tomó la decisión del segundo tiempo operatorio.
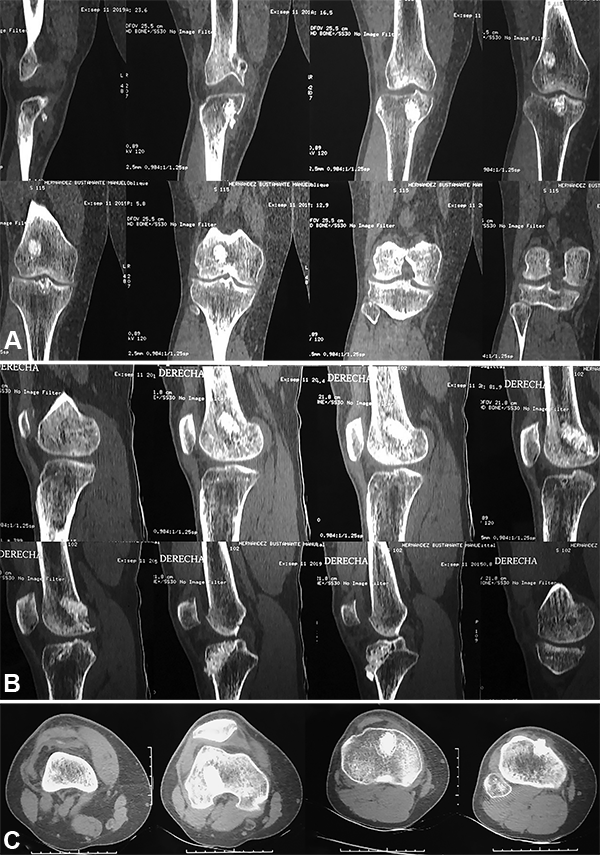
Figura 9: TAC post operatoria donde se ve el relleno de los túneles.
Segundo tiempo operatorio: Plástica intraarticular
La posición y anestesia fue similar al primer tiempo operatorio. Se inspecciono la cara medial del cóndilo lateral por portales medial y lateral, y se evaluó el estado óseo del túnel previamente desbridado y rellenado encontrándolo satisfactorio (fig. 10).
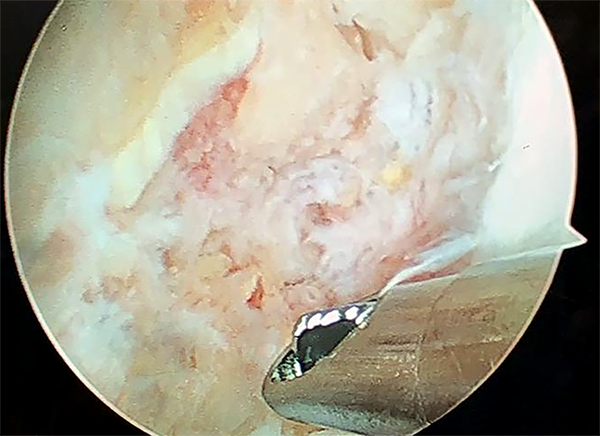
Figura 10: Visión artroscópica de cara medial cóndilo lateral para realizar nuevo túnel.
Al estar disponible se utilizó como injerto el tendón rotuliano autólogo. Los tacos óseos se prepararon de 25 mm de largo y 9 mm de diámetro en fémur y tibia. En el lado femoral se realizó un orificio de 2 mm en la parte proximal a 1 cm del extremo y 3 orificios en la parte distal tibial. En el proximal se colocó un dispositivo de fijación cortical ajustable y en el distal 3 suturas fuertes de poliéster trenzado para la tracción final. El injerto más las suturas del botón de fijación proximal deben pasar lo más justo posible por el medidor de diámetro de 10 mm (fig. 11).
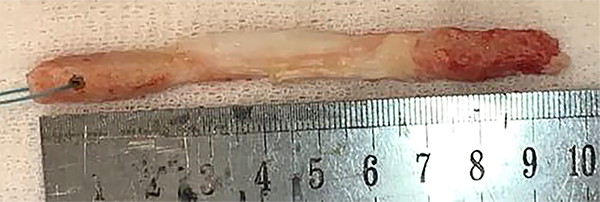
Figura 11: Injerto rotuliano preparación botón de fijación.
Se ubicó la posición anatómica más isométrica del punto de inserción femoral anatómico conocida como posición I.D.E.A.L. (marca registrada) con la rodilla en 120 grados de flexión y con una guía femoral del diámetro planeado de 10 mm.9
Colocamos el alambre guía, y empezando con fresas de 7 mm de diámetro se va perforando y dilatando el nuevo túnel hasta el diámetro planificado de 10 mm (fig. 12).
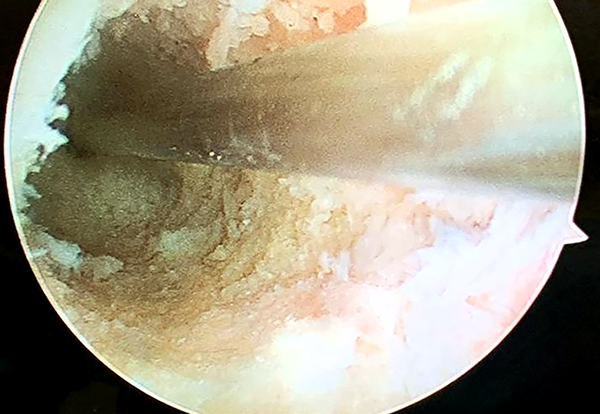
Figura 12: Preparación del nuevo túnel femoral.
El túnel tibial se realizó con la guía que nos permite elegir, basados en la anatomía artroscópica, el lugar donde va a salir nuestro alambre, tratando que el origen del mismo en la tibia sea lo más distal posible y en otro ángulo que el túnel previo. Se tomó como referencia anteroposterior para la salida intraarticular el borde posterior del cuerno anterior del menisco externo y entre las espinas tibiales como referencia medio lateral. Se perforo el túnel de manera creciente hasta 9 mm, y luego se utiliza el medidor de impingememt de 10 mm como dilatador, realizando un control endoscópico seco del estado del túnel tibial al finalizar (fig. 13).
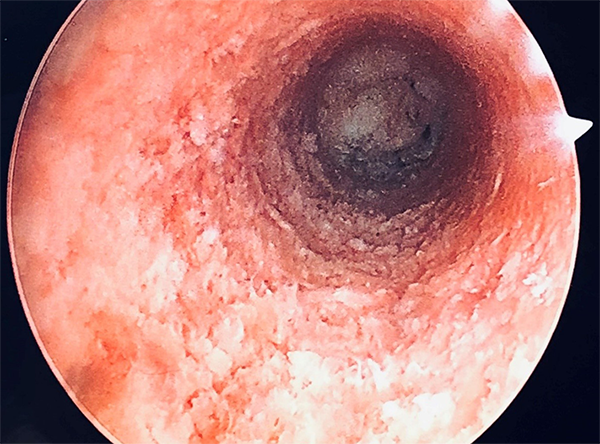
Figura 13: Visión endoscópica del nuevo túnel tibial.
Se pasa una sutura tractora a través del túnel femoral y tibial, que va a llevar la sutura tractora del botón a la parte lateral del fémur. El botón pasa por el túnel tibial luego intraarticular y se fija a la cortical femoral lateral comprobando la correcta fijación del mismo mediante fuerte tracción y con visión directa en el túnel. Las suturas previamente marcadas que van a traccionar el injerto se recuperan por el portal medial e introducimos el injerto en el túnel tibial y a través de la articulación en el túnel femoral. Una vez pasado el injerto manteniendo tensionado el injerto desde distal se realizan movimientos de flexo extensión para ajustar el sistema de fricción del sistema de fijación e igualar la tensión del ajuste y se re tensiona el botón femoral. La fijación tibial se realiza con la rodilla en 10 grados de flexión con un tornillo interferencia de 10 mm de PEEK. Retencionamos a proximal nuevamente traccionado desde el lado femoral todo el injerto una vez finalizado la fijación en la tibia (fig. 14).
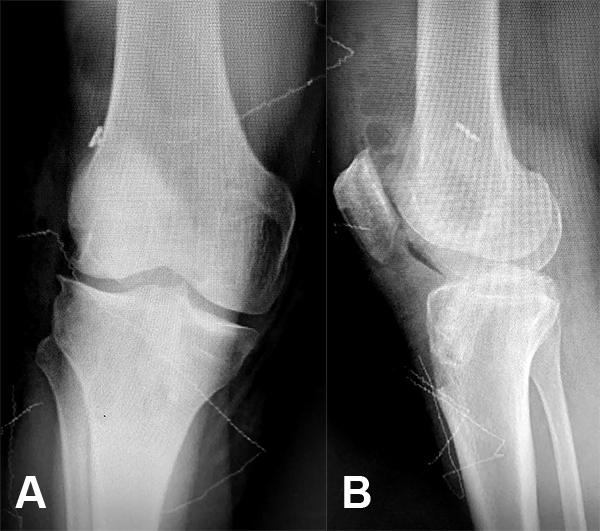
Figura 14: Control RX
Colocamos una férula en extensión para confort del paciente comenzando el apoyo y permitiendo la recuperación funcional ganado rango de movimiento a partir de las 48 hs en forma suave y progresiva.
Retiramos toda protección entre la primera y segunda semana.
Estimulamos los Ejercicios de propiocepción y equilibrio en forma inmediata, utilizando un protocolo de rehabilitación estandarizado, no acelerado, con alta para actividades con pivoteo más intensas a partir del noveno mes, y luego de cumplir con las pruebas funcionales específicas.
DISCUSIÓN
Esta técnica está reservada para casos complejos con pérdida de hueso importante, ya que incluye 2 procedimientos quirúrgicos con sus riesgos asociados y un mayor periodo de inactividad. Sin embargo, en casos selectos, esta técnica evita la morbilidad en zona dadora de injerto óseo utilizando aloinjerto molido, genera un aumento del capital óseo para la osteointegración de la nueva plástica, asegura una fijación adecuada y aporta mejor estabilidad rotacional (Tabla 1).
Tabla 1: Ventajas y limitaciones de la técnica
| Ventajas |
| Se pueden orientar los nuevos túneles sin restricciones. |
| No hay riesgo de zona dadora del injerto óseo. |
| El sustrato óseo para la recepción del injerto es bueno y sin morbilidad |
| El uso de injerto de tendón rotuliano autólogo permite disponer de un tendón fuerte y con aporte óseo. |
| Se incrementa la estabilidad rotacional con la tenodesis extraarticular en el primer tiempo. |
| La fijación cortical ajustable específica para injerto de tendón rotuliano asegura la capacidad de fijar cualquier injerto autólogo o alógeno y evitar fijaciones interferenciales en la zona previamente rellenada. |
| Limitaciones |
| Dos procedimientos quirúrgicos con mayor riesgo y costo. |
| Mayor tiempo de recuperación por la espera en relleno de túneles. |
| Mayor costo económico del injerto óseo y problemas de disponibilidad. |
| Riesgo de transmisión de enfermedades. |
| Mayor exposición a radiaciones (2 TAC). |
Luego de un interrogatorio donde se confirma el episodio clínico de inestabilidad referido por el paciente se realiza el examen físico para confirmar la inestabilidad siendo la prueba de Lachman la más sensible y la prueba del pivote la más específica, especialmente bajo anestesia.10-12
Otras pruebas se realizan siempre en estos casos complejos y recurrentes para descartar otras lesiones ligamentarias asociadas con insuficiencia de otros estabilizadores secundarios. Las radiografías simples en frente perfil y axial son rutinarias, y sirven para ver la presencia de los túneles previos y la ubicación de los materiales de fijación, siendo la posición de frente la mejor para evaluar el túnel femoral y el perfil para el túnel tibial.13,14
Otras posiciones radiográficas como la posición de Rosemberg, radiografías con apoyo mono podálico o de todo el miembro no son rutinarias, pero pueden ser de utilidad para casos especiales.
Luego de las radiografías solicitamos una RMN que nos permite ver la posición de los túneles y una estimación del ensanchamiento de los mismos y las lesiones agregadas meniscales y ligamentarias.15,16
La TAC es el patrón de oro para la medición de los túneles, y es vital en la toma de decisiones en 1 o 2 tiempos.17-19
No hay un consenso acerca de cuál es el valor límite de corte para la decisión, pero algunos autores recomiendan la cirugía diferida en 2 tiempos cuando la medición de los túneles es mayor de 10 a 15 mm.12,20,21
Otros autores toman como referencia túneles mayores de 16 mm.22 Dada la dispersión de valores está claro que son valores subjetivos y dependen de la experiencia del cirujano, del injerto disponible y de los métodos de fijación a utilizar.
La osteólisis de los túneles, el ensanchamiento y expansión de los mismos, tiene una etiología desconocida, pero se cree que factores mecánicos y biológicos son los responsables de este proceso de lisis ósea.
A pesar que la movilidad del injerto por una fijación suspensoria es la teoría mecánica predominante, otros factores pueden contribuir como: la compresión de tejido blando en hueso debilitado, posición no anatómica que resulte en fuerzas no fisiológicas, rehabilitación acelerada y stress shielding.23,24
Causas biológicas incluyen: interferencia de líquido sinovial en el túnel, edema del injerto y citoquinas inflamatorias.25,26 La aparición de múltiples formas de lisis avala la teoría multifactorial.
Con respecto a la elección del injerto para el relleno de los túneles, nosotros utilizamos aloinjerto molido cortico esponjoso compactado. Las diferentes posibilidades y sus características se resumen en la tabla 2. La bibliografía no es categórica al respecto y se deben hacer evaluaciones individuales, pero una reciente revisión sistemática mostraría que el uso de aloinjerto óseo en vez de autoinjerto estaría relacionado a una mayor tasa de falla en estos pacientes.26
TABLA 2: Opciones de injerto en revisión de LCA
| INJERTO OSEO |
BENEFICIO |
CONTRA |
| Cresta Iliaca autólogo |
Estructural disponible volumen |
Morbilidad |
| Platillo tibial autólogo |
Local misma incisión |
Difícil técnicamente cantidad limitada |
| Autólogo Gerdy |
Local |
Cantidad limitada |
| Injerto molido compactado alogénico |
No morbilidad sitio dador |
Solo osteoconductivo costo |
| Espigas ósea aloinjerto |
No morbilidad sitio dador versátil |
Disponibilidad costo |
El uso de la tenodesis extraarticular en el primer tiempo operatorio, ayuda a una estabilización rotacional luego de la primera etapa quirúrgica protegiendo la rodilla. No hay un consenso claro en la literatura de cuál es la indicación más adecuada para este procedimiento, ni que técnica es mejor para incrementar la estabilidad rotacional en este tipo de pacientes. Tampoco la posición de tensión. Tratamos de no sobre constreñir el compartimento lateral fijando la plástica en 45 grados de flexión en rotación neutra.
Para el intervalo entre los 2 tiempos quirúrgicos, nosotros tomamos el valor arbitrario de 4 meses, que es cuando pedimos radiografías y una nueva TAC. La aparición de los túneles delimitados con bordes esclerosos pero rellenos con injerto de densidad similar al hueso circundante lo tomamos como signo de incorporación. En diferentes estudios los tiempos entre el primer tiempo y el segundo varían entre 3 y 8 meses, variación que está relacionada con el uso de diferentes tipos de injertos óseos y métodos de evaluación de la incorporación.27
La elección del injerto para la plástica ligamentaria es importante, pero depende de muchos factores. El cirujano tiene que estar familiarizado con diferentes tipos de injertos y métodos de fijación. También con el uso de diferentes técnicas de acceso al punto femoral elegido.
La bibliografía muestra que el índice de re ruptura es 2.78 veces mayor con el uso de aloinjerto, por lo que no es nuestra primera elección.28,29 Si está disponible el injerto de tendón rotuliano autólogo lo preferimos. Nos permite disponer de un injerto fuerte y con aporte de hueso en el túnel. Si no está disponible, evaluamos que otras posibilidades de injerto de la misma rodilla está disponible (STRI – cuadricipital), y evaluamos sus ventajas y desventajas en función de la tercera opción que es el aloinjerto de tendón Rotuliano.
Escapa al objetivo de esta presentación el análisis más detallado de los diferentes injertos posibles y sus cualidades, pero siempre hacemos una evaluación personalizada y la decisión es la que consideramos más adecuada para cada paciente.
Reservamos el aloinjerto en casos que no hubiera disponible injerto autólogo en la misma rodilla o en algunos pacientes mayores de 40 años, donde nuestra experiencia nos muestra que son un grupo etario que ya sea por razones laborales, biológicas o motivacionales, les cuesta mucho más recuperar la funcionalidad y el trofismo muscular. No utilizamos injerto de rodilla contralateral.
La fijación que utilizamos siempre es cortical y ajustable, para que la fortaleza en la misma este en la cortical que habitualmente está menos comprometida, y la unión hueso receptor e injerto sea lo más justa posible. La utilización de un botón ajustable de fijación cortical específico para la fijación de un tendón de tendón rotuliano con injerto óseo en los extremos, es de gran utilidad para cumplir este objetivo. A pesar que la imagen radiográfica y tomografía muestra buena densidad ósea, tratamos de evitar la fijación interferencial en la zona de relleno de injerto. No hay estudios de nuestro conocimiento que confirmen la fortaleza y propiedades biomecánicas de ese hueso esponjoso injertado para una fijación interferencial de apertura.
Este trabajo describe la técnica y es a propósito de un caso en particular. Nuestra serie actual es muy pequeña, 3 casos realizados con esta técnica y en evolución. Hay pocos estudios referidos exclusivamente a los resultados de la revisión en 2 tiempos. Son pocos casos y con diferentes técnicas de relleno, de elección de injerto y métodos de fijación por lo que hace muy difícil sacar conclusiones.
Franceschi evaluó 30 pacientes en los cuales se retiró el implante y se rellenó el túnel en el primer tiempo con autoinjerto de la metáfisis tibial, y se realizó el segundo tiempo luego de un mínimo de 3 meses y después de que estudios tomográficos confirmaran el relleno de los túneles. Realizaron una técnica transtibial con injerto STRI autólogo.
A 5 años postoperatorio el 86.7% tenían extensión completa, 90% una diferencia menor de 5 grados en la flexión comparado con la contralateral, 66.7 % retornaron al nivel deportivo pre injuria y un aumento significativo en el score de Lyshom.30
Thomas reporta los resultados de 49 casos donde se retiró el material de fijación y se rellenó con injerto los túneles en el primer tiempo, seguido por una plástica de LCA con varios injertos y diferentes métodos de fijación. Este grupo se comparó con cirugías de revisión de 1 tiempo.
El grupo de revisión en dos tiempos tenía muchos más pacientes con patología condral y meniscal que el grupo en 1 tiempo.
A los 6 años hubo una mejoría en el score IKDC, pero mayor en el grupo de revisión en 1 tiempo, sin embargo, las mediciones objetivas de laxitud no mostraban diferencias significativas.31
CONCLUSIÓN
La cirugía de revisión en 2 tiempos quirúrgicos tiene un pronóstico más reservado que la cirugía primaria.
Una planificación cuidadosa, técnica quirúrgica meticulosa, rehabilitación paciente específica y expectativas realistas, mejoran las posibilidades de buenos resultados en estos desafiantes pacientes.
Estos deben entender que el tiempo de su vuelta al deporte es mayor en las cirugías de revisión y va a depender de su habilidad de recuperar fuerza simétrica comparada con la contralateral y de completar las pruebas específicas de rendimiento.
Debemos asegurarnos que el paciente entiende esto, para evitar la sensación de fracaso si la vuelta al deporte no se logra a pesar de obtener una rodilla estable y mejorar su calidad de vida.
BIBLIOGRAFÍA
- Gomoll AH, Bach BR. Managing tunnel malposition and widening in revision anterior cruciate ligament surgery. Oper Tech Sports Med 2006;14:36-44.
- Buyukdogan K, Laidlaw MS, Miller MD. Two-stage revision anterior cruciate ligament reconstruction using allograft bone dowels. Arthrosc Tech 2017;6:e1297-e1302.
- Chahla J, Dean CS, Cram TR, et al. Two-stage revision anterior cruciate ligament reconstruction: Bone grafting technique using an allograft bone matrix. Arthrosc Tech 2016;5:e189-e195.
- Ohly NE, Murray IR, Keating JF. Revision anterior cruciate ligament reconstruction. J Bone Joint Surg Br2007;89-B:1051-1054.
- Wright RW, Huston LJ, Spindler KP, et al. Descriptive epidemiology of the Multicenter ACL revision study (MARS) cohort. Am J Sports Med 2010;38:1979-1986.
- Wilde J, Bedi A, Altchek DW. Revision anterior cruciateligament reconstruction. Sports Health 2014;6:504-518.
- Erickson BJ, Cvetanovich GL, Frank RM, Riff AJ, Bach BR. Revision ACL reconstruction: A critical analysis review. JBJS Rev 2017;5:e1.
- Burnham JM, Herbst E, Pauyo T, et al. Technical considerations in revision anterior cruciate ligament reconstruction for operative techniques in orthopaedics. Oper Tech Orthop 2017;27:63-69.
- Pearle, A.D. et al. Rationale for Strategic Graft Placement in Anterior Cruciate Ligament Reconstruction: I.D.E.A.L. Femoral Tunnel Position. Am J Orthop 44:6:253-8, 2015.
- Meuffels DE, Poldervaart MT, Diercks RL, et al. Guidelineon anterior cruciate ligament injury. Acta Orthop 2012;83: 379-386.
- Shea KG, Carey JL, Richmond J, et al. The American Academy of Orthopaedic Surgeons evidence-based guideline on management of anterior cruciate ligament injuries. J Bone Joint Surg Am 2015;97:672-674.
- van Eck CF, van den Bekerom MP, Fu FH, Poolman RW, Kerkhoffs GM. Methods to diagnose acute anterior cruciate ligament rupture: a meta-analysis of physical examinations with and without anaesthesia. Knee Surg Sports Traumatol Arthrosc. 2013;21(8):1895-1903.
- Allen CR, Giffin JR, Harner CD. Revision anterior cruciate ligament reconstruction. Orthop Clin North Am. 2003; 34(1):79-98.
- Scott WN. Insall & Scott Surgery of the Knee. 5th ed. New York, NY: Elsevier Churchill Livingstone; 2012.
- Fules PJ, Madhav RT, Goddard RK, Newman-Sanders A, Mowbray MA. Evaluation of tibial bone tunnel enlargement using MRI scan cross-sectional area measurement after autologous hamstring tendon ACL replacement. Knee. 2003; 10(1):87-91.
- Siebold R. Observations on bone tunnel enlargement after double-bundle anterior cruciate ligament reconstruction. Arthroscopy. 2007; 23(3):291-298.2007; 23(3):291-298.
- Groves C, Chandramohan M, Chew C, Subedi N. Use of CT in the management of anterior cruciate ligament revision surgery. ClinRadiol. 2013; 68(10):e552-e559.
- Marchant MH Jr, Willimon SC, Vinson E,Pietrobon R, Garrett WE, Higgins LD. Com-parison of plain radiography, computed tomography, and magnetic resonance imaging in the evaluation of bone tunnel widening af-ter anterior cruciate ligament reconstruction. Knee Surg Sports Traumatol Arthrosc. 2010;18(8):1059-1064.
- Azar FM. Revision anterior cruciate ligament reconstruction. Instr Course Lect. 2002 51:335-342.
- Harner CD, Giffin JR, Dunteman RC, Annunziata CC, Friedman MJ. Evaluation and treatment of recurrent instability after anterior cruciate ligament reconstruction. Instr Course Lect. 2001; 50:463-474.
- Morgan CD, Stein DA, LeitmanEH, Kalman VR. Anatomic tibial graft fixation using a retrograde bio-interference screw for endoscopic anterior cruciate ligament reconstruction. Arthroscopy.2002; 18:E38.
- Kamath GV, Burks RT, Redfern JC, et al. Revision anterior cruciate ligament reconstruction. Clinicalsports medicine update. Am J Sports Med. 2011; 39:199-217.
- Zijl JA, Kleipool AE, Willems WJ. Comparison of tibial tunnel enlargement after anterior cruciate ligament reconstruction usingppatellar tendon autograft or allograft. Am J Sports Med. 2000; 28:547-551.
- Cameron M, Buchgraber A,Passler H, et al. The natural his-tory of the anterior cruciate liga-ment-deficient knee: changes in synovial fluid cytokine and kera-tin sulfate concentrations. Am JSports Med. 1997; 25:751-754.
- Clatworthy MG, Annear P, BulowJU, et al. Tunnel widening in anterior cruciate ligament reconstruction: a prospective evaluation of hamstring and patella tendon grafts. Knee Surg Sports Traumatol. Arthrosc. 1999; 7:138-145.
- Salem HS(1), Axibal DP(1), Wolcott ML(1), Vidal AF(1), McCarty EC(1), Bravman JT(1), Frank RM(1). Two-Stage Revision Anterior Cruciate Ligament Reconstruction: A Systematic Review of Bone Graft Options for Tunnel Augmentation. Am J Sports Med. 2019 May 22:363546519841583. doi: 10.1177/0363546519841583. (1)University of Colorado School of Medicine, Aurora, Colorado, USA.
- Kamath GV, Burks RT, Redfern JC, et al. Revision anterior cruciate ligament reconstruction. Clinical sports medicine update. Am J Sports Med. 2011; 39:199-217.
- MARS Group. Effect of graft choice on the outcome of revision anterior cruciate ligament reconstruction in the Multicenter ACL Revision Study (MARS) cohort. Am J SportsMed. 2014; 42(10):2301-2310.
- MARS Group, Wright RW, Huston LJ, et al.Descriptive epidemiology of the Multicenter ACL Revision Study (MARS) cohort. Am JSports Med. 2010; 38(10):1979-1986.
- Franceschi F, Papalia R, Del Buono A, etal. Two-stage procedure in anterior cruciate ligament revision surgery: a five-year fol-low-up prospective study. Int Orthop. 2013;37(7):1369-1374.
- Thomas NP, Kankate R, Wandless F, PanditH. Revision anterior cruciate ligament reconstruction using a 2-stage technique with bone grafting of the tibial tunnel. Am J Sports Med.2005; 33(11):1701-1709.