Terapias biológicas en artroscopía de rodilla. De las ciencias básicas a la aplicación clínica
Dr. Ignacio Dallo 1, Dr. Horacio F. Rivarola Etcheto 2, Dr. Cristian Collazo 2, Dr. Jorge Chahla 3, Dr. Alberto Gobbi 4
1 Sanatorio Garay, Santa Fe. O.A.S.I. Bioresearch Foundation, Milano, Italia.
2 Hospital Universitario Austral. Hospital Universitario Fundación Favaloro, Buenos Aires.
3 Rush University Medical Center, Chicago, Estados Unidos
4 O.A.S.I. Bioresearch Foundation, Milano, Italia.
Ignacio Dallo
info@drignaciodallo.com.ar
RESUMEN
Las estructuras intraarticulares, como el cartílago, el ligamento cruzado anterior (LCA) y los meniscos tienen un potencial de cicatrización limitado una vez que se lesionan. Un mayor conocimiento de las ciencias básicas y el advenimiento de las terapias biológicas han creado un gran interés en la utilización de diferentes estrategias de aumentación, cuyo objetivo es facilitar el proceso de cicatrización de dichas estructuras de la rodilla. Nuestro propósito es presentar una revisión de los conceptos actuales sobre las terapias biológicas en artroscopía de rodilla.
Se realizó una revisión de la literatura que incluyó búsquedas en las bases de datos PubMed, Medline, Embase y Cochrane, utilizando las siguientes palabras clave: terapias biológicas, lesión del LCA, lesión meniscal, lesión del cartílago articular, PRP, BMAC, Bio-Ortopedia y Ortobiológicos.
Se ha reportado que la utilización de técnicas biológicas de aumentación, incluidas el plasma rico en plaquetas (PRP), la médula ósea concentrada (BMAC) y otras terapias celulares para lesiones del cartílago articular, del LCA y de los meniscos podría facilitar el proceso de cicatrización con resultados clínicos prometedores.
Podemos concluir que, efectivamente, existe un creciente interés en la utilización de terapias biológicas en las lesiones de rodilla con resultados clínicos heterogéneos, pero promisorios. Se necesitan estudios adicionales, randomizados, prospectivos, controlados y comparativos para determinar la eficacia real de las diferentes estrategias de aumento biológico en el entorno clínico.
Tipo de estudio: Actualización
Nivel de evidencia:
Palabras clave: Terapias Biológicas; Lesiones de rodilla; PRP; BMAC; Bio-Ortopedia; Ortobiológicos
ABSTRACT
Intra-articular structures such as articular cartilage, anterior cruciate ligament (ACL), and menisci have limited healing potential after injury. The greater knowledge of the basic sciences and the advent of biological therapies have created a great interest in the use of different augmentation strategies, whose objective is to facilitate the healing process of these knee structures.
To present a current concept review on the use of biological therapies in knee arthroscopy.
A literature review was performed that included searches of the PubMed, Medline, Embase and Cochrane databases using the following keywords: Biological therapies, ACL tears, meniscal tears, articular cartilage injury, PRP, BMAC, Bio-Orthopaedics and Orthobiologics.
It has been reported that the use of biological augmentation techniques, including Platelet rich plasma (PRP), bone marrow aspirate concentrate (BMAC), and other cellular therapies for injuries to articular cartilage, ACL, and menisci, could facilitate the healing process with promising clinical results.
There is a growing interest in the use of biological therapies in knee injuries with heterogeneous but promising clinical results. Additional, randomized, prospective, controlled, and comparative studies are needed to determine the true efficacy of different biological augmentation strategies in the clinical setting.
Type of study: Current concept review
Level of evidence:
Keywords: Biological Therapies; Knee Injuries; PRP; BMAC; Bio-Orthopaedics; Orthobiologics
INTRODUCCIÓN
Con el advenimiento de las terapias autólogas se puede apreciar un creciente interés en la utilización de terapias biológicas en artroscopía de rodilla. Estas terapias usan factores de crecimiento y células para facilitar la cicatrización, disminuir la inflamación y, posteriormente, provocar un efecto analgésico después de una lesión, con un riesgo relativamente bajo de complicaciones.
Los enfoques biológicos utilizados comúnmente en la actualidad incluyen el plasma rico en plaquetas (PRP), concentrado de aspirado de médula ósea (BMAC) y tejido adiposo autólogo microfragmentado. Estos tratamientos pueden contribuir a un microambiente regenerativo con el potencial de mejorar las tasas de cicatrización y la función articular en pacientes con lesiones de rodilla. La Academia Americana de Cirujanos Ortopédicos (AAOS) definió estas terapias biológicas como sustancias que se pueden encontrar naturalmente en el cuerpo y que ayudan en el proceso de cicatrización en las lesiones musculoesqueléticas.1 Se recomienda que los médicos e instituciones que las ofrezcan dispongan de registros de pacientes para la vigilancia y valoración de calidad. Actualmente se realizan varios ensayos clínicos que evalúan estas terapias a pesar de la comprensión limitada de la fisiopatología subyacente de las diferentes lesiones articulares y sin una caracterización completa de sus componentes.
En este artículo describiremos el estado actual de las ciencias básicas y la utilización clínica de las terapias biológicas en artroscopía de rodilla.
CIENCIAS BÁSICAS DE LAS TERAPIAS BIOLÓGICAS
Plasma rico en plaquetas
El plasma rico en plaquetas (PRP) es un derivado de la sangre, producido por centrifugación o filtración de la sangre completa para concentrar o aislar las plaquetas a un nivel más alto (generalmente 2-5 veces más) que los niveles plasmáticos normales.2 La razón de esta variabilidad en la concentración de plaquetas se explica por los diferentes métodos disponibles para producir el PRP (por ejemplo, diferentes protocolos de centrifugación y el desarrollo de varios kits comerciales).3 Esto contribuyó a generar confusión en la literatura, ya que hay varios productos que pueden diferir en términos de sus efectos y de sus indicaciones, lo que dificulta la posibilidad de comparar los estudios y entender la verdadera efectividad del PRP en las diversas aplicaciones y condiciones de estudio.
Independientemente de los métodos de producción y la concentración de plaquetas, el PRP se caracteriza por una alta concentración de una gran composición de factores de crecimiento (FC) y citocinas involucradas tanto en el proceso de cicatrización como en la inmunoregulación. Estos mediadores biológicos se liberan por exocitosis de los gránulos α de las plaquetas, así como por la interrupción de la membrana que puede ocurrir durante la manipulación de este derivado sanguíneo después de su activación con un estallido inicial, seguido de una liberación sostenida adicional. Existen diferentes métodos para activar el PRP que podrían influir en la curva de liberación, pero actualmente el cloruro de calcio es el más común. En particular, el cloruro de calcio al 5% parece ser efectivo para obtener una alta concentración de mediadores biológicos en el PRP, aunque algunos productos también se promueven sin el uso de un activador, dependiendo de la activación espontánea inducida por el contacto con el colágeno in situ una vez que se inyecta el PRP. La alta cantidad de FC liberados es la responsable de los múltiples efectos del PRP, tales como el efecto anabólico y la mejora de la migración, proliferación y diferenciación celular, la neoformación de vasos, la modulación de la inflamación e inmunoregulación y la síntesis de proteínas de la matriz extracelular.4, 5 Entre los FC más estudiados secretados por las plaquetas se encuentran el factor de crecimiento endotelial vascular (VEGF), el de fibroblastos (FGF), el factor de crecimiento derivado de plaquetas (PDGF), el similar a la insulina-1 (IGF-1), la interleucina-10 (IL-10), el factor de crecimiento transformante-β1 (TGF- β1), el factor epidérmico de crecimiento (EGF) y el factor de crecimiento de hepatocitos (HGF).6
Los efectos de estos FC se han analizado exhaustivamente a través de estudios in vitro e in vivo:7 se ha demostrado que el TGF-β1 mejora la deposición de la matriz e induce la diferenciación condrogénica y la proliferación celular, y favorece la expresión de colágeno de tipo II (cartílago hialino) y la de proteoglicanos en contraste con el efecto de la IL-1. Además, induce la migración hacia el sitio de la lesión, la proliferación y la diferenciación condrogénica de las células del estroma de la médula ósea (BMSC). El VEGF es una proteína de señalización implicada en la angiogénesis, junto con otros factores angiogénicos. El FGF estimula la proliferación de fibroblastos y contribuye a la angiogénesis. El PDGF incentiva la proliferación celular y la angiogénesis, y tiene un papel mitogénico para los fibroblastos. El IGF-1 mejora la deposición de la matriz y estimula la proliferación celular y la diferenciación de fibroblastos; por otra parte, es un mediador en el crecimiento y la reparación del músculo esquelético. Evidencias recientes han identificado en el IGF-1 un posible inhibidor de la apoptosis, regulando la expresión de la proteína PDCD 5.8 El EGF activa la proliferación y migración de células mesenquimales y epiteliales. El HGF estimula la angiogénesis y el incremento de células endoteliales, tiene un papel antifibrótico y aumenta el nivel de citocinas antiinflamatorias. La IL-10 es una citocina antiinflamatoria.
Además de la razón biológica, la evidencia actual apoya el papel del PRP en modulación del ambiente intraarticular inflamatorio en enfermedades degenerativas: después de una acción proinflamatoria inicial, con la estimulación de los sinoviocitos para liberar metaloproteinasas y citocinas, se ha demostrado una siguiente fase de modulación y reducción de la respuesta inflamatoria, con una disminución de las citocinas proinflamatorias, que contrasta con la quimiotaxis de las células de tipo monocito.9 Por otra parte, la literatura preclínica también mostró un efecto analgésico del PRP, posiblemente mediante el aumento de los receptores de cannabinoides.10 Con base en esta evidencia, es importante subrayar que el PRP puede no promover directamente la regeneración de tejidos, sino que puede actuar a través de sus diferentes moléculas bioactivas que afectan la homeostasis de los tejidos, ralentizando los procesos catabólicos y degenerativos, y ofreciendo un beneficio en términos de alivio de los síntomas y mejora funcional. Gracias a estos efectos biológicos, se han encontrado en el PRP diferentes aplicaciones clínicas a lo largo de los años, desde la odontología, cirugía maxilofacial, cirugía plástica, dermatología, hasta la cirugía ortopédica con diferentes evidencias de efectividad. La confusión con respecto a la efectividad del PRP deriva principalmente de los diferentes métodos y protocolos para su obtención y preparación, con diversas características en términos de plaquetas, leucocitos, glóbulos rojos y contenido de fibrina, que pueden causar distintas particularidades biológicas y mecánicas. Por estas razones, en 2009, Dohan Ehrenfest y col. dividieron el PRP en cuatro categorías, de acuerdo con la arquitectura de fibrina y el contenido de leucocitos: plasma rico en plaquetas puro (P-PRP), plasma rico en plaquetas y leucocitos (L-PRP), fibrina rica en plaquetas pura (P-PRF ), fibrina rica en plaquetas y leucocitos (L-PRF).11 Cada categoría presenta algunas especificidades principales y, también dentro de la misma categoría, cada producto diferente tiene su propia individualidad. Por ejemplo, varios estudios evaluaron el comportamiento diferente del P-PRF y el P-PRP, revelaron que el P-PRF permanece sólido e intacto y continúa liberando por más tiempo una gran cantidad de FC producidos por la población celular. En cambio, el P-PRP libera la mayoría de los FC en las primeras horas.11, 12
Otro parámetro de esta clasificación es la presencia / ausencia de leucocitos. Algunos autores sostienen que la presencia de leucocitos puede proporcionar una estimulación del proceso inflamatorio, mientras que otros sostienen que la presencia de leucocitos13 en el PRP puede aumentar los FC y la producción de los mediadores antinociceptivos.14, 15 También proveen una actividad antimicrobiana.16 En general, los leucocitos tienen un papel clave en la regulación de los procesos inflamatorios y de cicatrización, pero esto sigue siendo hoy en día uno de los puntos de discusión más importantes sobre el PRP. Independientemente de estas discrepancias, los diferentes tipos de PRP se han aplicado en la práctica clínica, y han mostrado resultados prometedores como tratamientos mínimamente invasivos para la osteoartritis de rodilla, donde parecieran proporcionar un beneficio sintomático a corto plazo.17
Sin embargo, aunque se conoce el fundamento biológico para el uso del PRP, y a pesar de algunos hallazgos clínicos prometedores, aún se necesitan más estudios, con una descripción detallada y precisa del protocolo de preparación del PRP, que permitan su comparación y proporcionar reproducibilidad para comprender mejor los diferentes efectos biológicos y clínicos de las distintas formulaciones, y así poder identificar las indicaciones más óptimas.18
Terapias celulares
La Sociedad Internacional de Terapia Celular propone criterios mínimos para definir las Células Madre Mesenquimales (MSCs) humanas. Primero, las MSCs deben ser adherentes al plástico cuando se mantienen en condiciones de cultivo estándar. En segundo lugar, deben expresar CD105, CD73 y CD90, y carecer de expresión de moléculas de superficie CD45, CD34, CD14 o CD11b, CD79alpha o CD19 y HLA-DR.19 En tercer lugar, las MSCs deben diferenciarse en osteoblastos, adipocitos y condroblastos in vitro. Actualmente, según Arnold Caplan, es más apropiado llamar a las MSCs como Células de Señalización Medicinal, ya que responden in vivo a una lesión secretando factores bioactivos que tienen un efecto inmunomodulador, proporcionando opciones terapéuticas prometedoras.20 La aplicación de MSCs podría facilitar el mecanismo de cicatrización de tejidos con un potencial limitado de reparación y vascularización, como lo son el cartílago articular, los meniscos y el ligamento cruzado anterior (LCA).
Según consenso en la opinión de los expertos, el término “célula madre” se ha empleado en exceso.21 Se recomienda que el uso de productos celulares mínimamente manipulados y células expandidas por cultivo derivadas de tejidos se denomine “terapia celular”, y la naturaleza de estos tratamientos debe entenderse claramente.
La investigación científica básica confirmó la prueba del concepto de que la terapia con MSCs regula la inflamación y produce un efecto analgésico. Pocos estudios muestran resultados clínicos prometedores a largo plazo para lesiones articulares. Como tal, existe una necesidad continua de investigación científica y clínica básica de alta calidad sobre la seguridad y la eficacia de las terapias basadas en células. La herramienta DOSES para describir las terapias celulares debe ser utilizada por médicos, investigadores, reguladores y profesionales de la industria para mejorar la transparencia y permitir que los médicos y los pacientes comprendan las características de las preparaciones celulares actuales y futuras.22
Se han desarrollado varios protocolos terapéuticos que implican el uso de MSC para aplicaciones clínicas, y han demostrado el potencial para mejorar los procesos regenerativos para muchas afecciones. Estas células pueden aislarse de una variedad de tejidos como el músculo, el periostio, la membrana sinovial, la médula ósea y el tejido adiposo. El concentrado de aspirado de médula ósea (BMAC) está clasificado a través de la Administración de Drogas y Alimentos de los Estados Unidos (FDA, por sus siglas en inglés) como un producto 361 y, por lo tanto, no está sujeto a revisión y aprobación previa a la comercialización. La base reguladora de la Unión Europea (UE), similar al sistema estadounidense, considera el proceso, como la centrifugación, una manipulación mínima.
BMAC tiene células progenitoras y factores de crecimiento con propiedades reparadoras, autodirigidas y tróficas que hacen que migren hacia áreas de daño. Una vez en el sitio de la lesión, las MSCs liberan citocinas y factores de crecimiento que inducen la actividad paracrina y autocrina, ayudando en el proceso de cicatrización y la modulación de la inflamación.23, 24 Los efectos paracrinos de las MSCs son responsables de la angiogénesis por liberación del factor de crecimiento endotelial vascular (VEGF) y factor de crecimiento de hepatocitos (HGF), así como inmunosupresión de linfocitos y células mononucleares de sangre periférica mediante la liberación de prostaglandina E2, factor inhibidor de leucemia y kinurenina.25 Recientemente, Cassano y col. encontraron una mayor concentración de antagonista del receptor de interleucina 1 (IL-1RA) en la médula ósea que, en combinación con los otros componentes, puede proporcionar efectos antiinflamatorios e inmunomoduladores.26 La terapia con células derivadas del tejido adiposo, también conocida como fracción vascular del estroma adiposo (SVF) o tejido adiposo autólogo microfragmentado, ha ganado popularidad recientemente como un producto mínimamente manipulado. El tejido adiposo, que generalmente está estructurado con vascularización constante, se ha reconocido cada vez más como una fuente confiable de estas células. También, en comparación con el BMAC, tiene la ventaja de obtener una fuente con mayor cantidad de MSCs.
Indicaciones clínicas
Los estudios han demostrado que los tejidos extraarticulares cicatrizan siguiendo una secuencia predefinida de eventos. Al principio, se produce una extravasación de sangre y la formación de un coágulo primario de fibrina-plaquetas que luego llena el espacio entre los extremos del tejido lesionado. Este proceso crea un andamio para que las células migren y remodelen el coágulo primario. En los siguientes pasos, se forma una cicatriz que llena el defecto. Por el contrario, una lesión en los tejidos intraarticulares (cartílago, ligamentos y meniscos) activa los sinoviocitos y aumenta la expresión del activador de plasminógeno, que se excreta en el entorno intraarticular. Como resultado, el plasminógeno presente en el líquido sinovial se convierte en plasmina, que degrada la fibrina. Por lo tanto, la fibrina en el espacio intraarticular es incapaz de formar un coágulo estable. La pérdida temprana de este andamio provisional se considera como una de las principales razones por la cual los tejidos dentro de las articulaciones no cicatrizan fácilmente.27
LESIONES DEL CARTÍLAGO ARTICULAR
El proceso patológico del cartílago articular tiene una alta prevalencia en la población general. Este proceso es producido por las agresiones causadas por un traumatismo articular único o cuando el cartílago está sometido a cargas de presión excesivas o repetitivas.
La avascularidad del cartílago articular, la escasa presencia de condrocitos y la incapacidad de migrar al sitio lesionado provocan una cicatrización lenta y, en muchos casos, un defecto permanente del cartílago.28 En condiciones fisiológicas, la aplicación de fuerza mecánica sobre la articulación produce un efecto biológico con aumento de la síntesis de colágeno y proteoglicanos, especialmente en la zona superficial.29
Plasma rico en plaquetas
Al comprender de antemano los procesos biológicos de la reparación de tejidos, el uso de terapias biológicas basadas en proteínas de señalización podría ser recomendable y útil. Es bien sabido que las plaquetas tienen un papel importante en la hemostasia, la inflamación y la proliferación para la remodelación y la cicatrización de los tejidos. Este potencial de curación inherente ha hecho que algunos autores utilicen los factores de crecimiento del plasma para el tratamiento de lesiones de cartílago.
Se ha comprobado que el PRP tiene un fuerte efecto positivo sobre la proliferación de los condrocitos in vitro, observado en una monocapa o en un entorno tridimensional. Estimula la síntesis de proteoglicanos y colágeno tipo II y también podría inducir la expresión de proteínas de diferenciación de condrocitos como el agrecano y Sox9.30 El PRP también puede provocar la disminución de los múltiples efectos inflamatorios mediados por la IL-1 beta en los condrocitos osteoartríticos humanos, incluida la inhibición de la activación de NF-κB.31 También se debe tener en cuenta que algunas formulaciones de PRP podrían ser proinflamatorias, y la presencia de leucocitos concentrados aumenta los niveles de moléculas de señalización catabólicas y proinflamatorias.
Se publicaron dos estudios sobre lesiones de cartílago de rodilla de espesor completo, tratados con una matriz de fabricación autóloga que consiste en chips de cartílago hialino, combinados con plasma mixto pobre en plaquetas en forma de coágulo y plasma rico en factores de crecimiento (PRGF) en etapa líquida. Se informaron buenos resultados clínicos y por resonancia magnética por imágenes (RMI), y retorno a actividad física (fútbol) de alto nivel.32 Esta técnica parece ser una excelente alternativa para las lesiones de cartílago, ya que puede realizarse en individuos jóvenes muy activos como una sola cirugía, es barata, no tiene intolerancia o potencial de rechazo, y ha demostrado características histológicas e inmunohistoquímicas muy similares al cartílago articular sano en estudios con animales.33, 34
Terapias celulares
Gobbi y col.,35 en un estudio prospectivo a diez años de seguimiento, concluyeron que la reparación de la lesión del cartílago de espesor total en la rodilla, con un andamio de ácido hialurónico embebido con médula ósea concentrada (HA-BMAC) proporciona buenos resultados clínicos en el tratamiento de lesiones pequeñas a grandes, aisladas o múltiples, y lesiones en uno o dos compartimentos, así como en casos de tratamiento de lesiones asociadas: todas con un seguimiento a largo plazo. Esta técnica de reparación del cartílago en una sola etapa podría tener un papel destacado en el tratamiento de defectos condrales ya que es una técnica simple, segura y accesible36 (fig. 1).
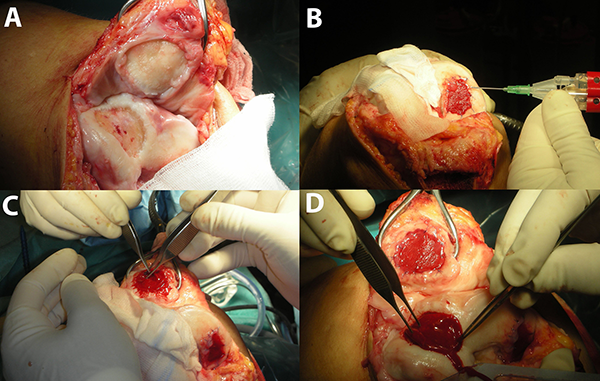
Figura 1: Imagen que muestra la técnica de un solo paso utilizando un andamio de ácido hialurónico embebido en médula ósea concentrada (HA-BMAC) para el tratamiento de lesiones de espesor completo del cartílago articular de la rodilla. A) Preparación de los defectos condrales en rótula y tróclea en una rodilla derecha. B) Aplicación del pegamento de fibrina para asegurar el injerto HA-BMAC dentro de una lesión en cóndilo femoral interno. C) Aplicación del injerto en el defecto rotuliano. D) Aplicación del injerto para un defecto condral en la tróclea.
Si bien entre los pacientes mayores de cuarenta y cinco años es dable esperar buenos resultados, estos pueden ser comparativamente más exitosos en pacientes más jóvenes. En su experiencia basada en la cuantificación de las unidades formadoras de colonias (UFC) en veinticinco pacientes, los autores no encontraron ninguna correlación entre los resultados clínicos y el número de UFC. Una explicación curiosa de estos resultados puede provenir de la nueva visión de las MSC recientemente propuesta por Caplan, como "células de señalización medicinales". Según este concepto, las MSC, en lugar de participar en la formación de tejidos, funcionan como "farmacias" reguladas en el sitio in vivo al liberar factores tróficos e inmunomoduladores y se activan por lesiones locales.37
En un estudio comparativo en cuarenta y seis pacientes con defectos condrales de espesor completo en cóndilo femoral, tratados con un injerto osteocondral sintético (TruFit) solo, aumentado con PRP o BMAC, Aaron Krych y col.38 demostraron mejoras, a los doce meses, en la maduración del cartílago con mayor relleno y valores medios de T2 más cercanos a los del cartílago hialino nativo superficial en los pacientes tratados con TruFit aumentado con BMAC. Los autores concluyeron que se necesitará un estudio adicional para determinar si esto puede traducirse en mejores resultados clínicos.
LESIONES DEL LIGAMENTO CRUZADO ANTERIOR
A diferencia de otros ligamentos de la rodilla, como el ligamento cruzado posterior (PCL) o el ligamento colateral medial (MCL), el LCA posee una capacidad intrínseca limitada para la cicatrización espontánea después de una lesión. Es por esto que el estándar de oro para el tratamiento de las lesiones del LCA es la técnica de reconstrucción artroscópica. Sin embargo, algunas series de casos publicadas han demostrado la cicatrización espontánea luego de una lesión del LCA.39 Debido a estos hallazgos y a un mayor conocimiento de las ciencias básicas de este ligamento junto con el advenimiento de las terapias biológicas, en la actualidad existen algunas estrategias para tratar de ayudar a mejorar el proceso de cicatrización del LCA y preservar el tejido ligamentario, o bien para mejorar su reconstrucción quirúrgica.
Lesiones parciales del LCA
Plasma rico en plaquetas
Seijas y col.40 aplicaron, en diecinueve jugadores de fútbol profesionales con ruptura parcial del LCA, aproximadamente 4 cc de factores de crecimiento derivados de las plaquetas (PRGF-Endoret) con una aguja espinal, en el origen proximal del fascículo sano y en su porción medial. Al final de la cirugía se administró otra inyección de PRGF-Endoret (6 cc) en el espacio articular. Quince pacientes regresaron a la actividad física en un promedio de 16.2 semanas (una re-ruptura al séptimo mes), mientras que tres pacientes lo hicieron en 12.3 semanas. Se realizó una resonancia magnética postoperatoria en todos los pacientes; se observó el resto del LCA con ligamentización completa al año de la cirugía y una buena disposición anatómica.
Terapias celulares
La inyección de BMAC y PRP bajo guía fluoroscópica o artroscópica (fig. 2), ha reportado buenos resultados clínicos a corto plazo con imágenes de resonancia magnética que muestran la cicatrización del LCA con lesiones parciales (fig. 3).41, 42
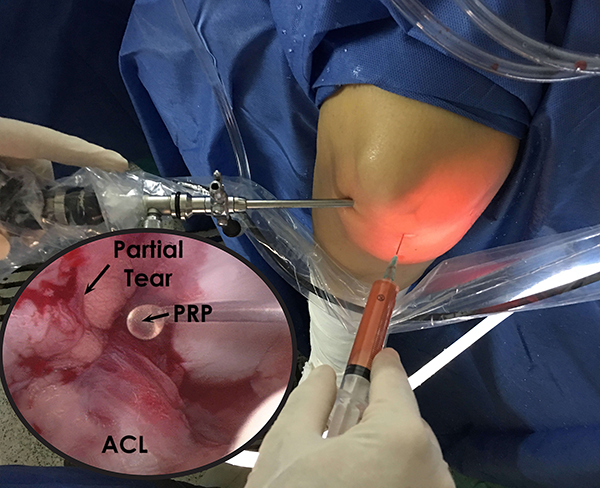
Figura 2: Imagen en la que se muestra la visión artroscópica, y del cirujano, de una infiltración con plasma rico en plaquetas (PRP) en una lesión parcial del ligamento cruzado anterior (LCA).
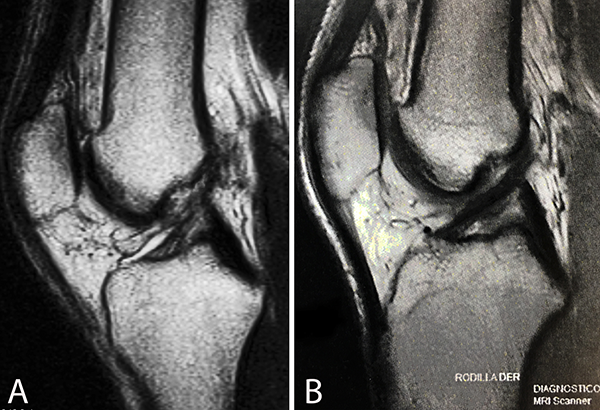
Figura 3: A) Imagen de resonancia magnética (RMI), vista sagital, de rodilla con señal hipertensa y heterogénea del LCA, compatible con una lesión parcial. B) RMI del mismo paciente a los ocho meses postinyección de BMAC y PRP intraligamentario con señal hipointensa y homogénea e isointensa con el LCP, compatible con cicatrización del LCA.
Gobbi y col.,43 en un estudio a largo plazo que evaluó a cincuenta pacientes, concluyeron que la reparación primaria con sutura de la banda lesionada a la banda sana del LCA, combinada con PRP y BMAC para tratar casos selectos de inestabilidad de rodilla secundaria a lesión incompleta, demostró una mejora estadísticamente significativa en los scores de Marx, Tegner, Lysholm, IKDC y KOOS a los diez años de seguimiento, con altas tasas de restauración de la estabilidad de la rodilla y retorno a las actividades deportivas previas a la lesión. La aplicación artroscópica de esta técnica en un tejido con baja capacidad regenerativa es una herramienta prometedora en casos muy bien seleccionados con lesiones parciales del LCA.44, 45
Reconstrucción del LCA
En cuanto a la utilización del PRP en la reconstrucción del LCA, la traducción de los hallazgos logrados en la investigación básica y en la práctica clínica ha generado resultados variables.46 Esta variabilidad podría deberse a la etapa temprana del uso de PRP en este tipo de cirugía, cuyos protocolos no están optimizados ni estandarizados, y su aplicación es muy heterogénea. En algunos casos, la elección de PRP puede ser clave ya que el uso de plasma rico en leucocitos podría dificultar la acción antiinflamatoria;47 de utilizarse en esta cirugía, los resultados podrían no ser los esperados.48 Además, la forma de aplicación del PRP también es un factor importante para obtener el resultado adecuado. Al aplicar el PRP en la reconstrucción del LCA es necesario inyectar tanto los túneles como el injerto (fig. 4). Esto favorece la ligamentización de los tendones utilizados como injerto, un efecto antiapoptótico y una mejor integración ósea.49 La falta de aplicación en cualquiera de estos componentes podría disminuir la efectividad de la técnica.50-52

Figura 4: Fotografía durante la infiltración con plasma rico en plaquetas (PRP) del injerto autólogo de semitendinoso y recto interno como aumento biológico de la reconstrucción del ligamento cruzado anterior (LCA) en una lesión completa.
Los autores de varios trabajos observaron mejoras en aspectos como el túnel óseo,53 la estabilidad articular54 y el retorno al nivel anterior de actividad, con cirugía en pacientes con lesiones del LCA.55 Se necesitan más estudios clínicos para optimizar el protocolo de aplicación utilizado en las lesiones de ligamentos.
LESIONES MENISCALES
La lesión del menisco que ocurre en proximidad cercana al plexo capilar perimeniscal (zona roja-roja) es susceptible de reparación. Desafortunadamente, es menos probable que las lesiones en la región avascular (zona blanca-blanca) puedan cicatrizar. Estos pacientes a menudo se someten a meniscectomía parcial para preservar la parte del menisco no dañada, aliviar el dolor y recuperar el rango de movimiento en la rodilla bloqueada. Las desventajas del tratamiento incluyen una mayor carga en el cartílago de la rodilla y la erosión de la superficie articular que conduce al desarrollo de la osteoartritis y, por lo general, al reemplazo total de la rodilla en un futuro próximo.23, 56 La progresión alentó a los cirujanos ortopédicos a desarrollar nuevas alternativas para el tratamiento de las lesiones ubicadas en la zona roja-blanca o blanca-blanca, comenzando con opciones simples como el raspado o abrasión del sitio de la lesión y de la membrana sinovial.57
A lo largo de los años, se han expuesto muchas técnicas ortobiológicas para mejorar la cicatrización de las lesiones meniscales en ensayos clínicos, incluidos los canales de acceso vascular, las microfracturas, la colocación de un coágulo de fibrina, el PRP, células de la médula ósea, del tejido adiposo o sinovial.58
Canales de acceso vascular y abrasión sinovial
Estos métodos simples se desarrollaron en la década del ochenta. La primera evidencia fue proporcionada por Arnoczky y col.59 y Gao60 en un modelo de lesión meniscal canino. Más tarde, Fox y col.61 analizaron la eficacia de la trepanación en lesiones meniscales incompletas, con resultados buenos a excelentes en el 90% de los pacientes. La abrasión sinovial fue efectiva en el entorno clínico para lesiones periféricas y pequeñas, y capaz de inducir la cicatrización del menisco sin fijación quirúrgica.62, 63
Coágulo de fibrina
El uso de coágulos de fibrina exógenos representa una técnica de aumento inicial en la reparación meniscal. Se demostraron buenos resultados en estudios preclínicos y clínicos.64
Plasma rico en plaquetas
Los coágulos de plasma ricos en plaquetas también estimulan la síntesis de ADN, la síntesis de matriz extracelular (ECM) y la expresión de ARNm de biglicano y decorina.23, 27 Se han llevado a cabo varios ensayos clínicos con PRP como adyuvante de la reparación quirúrgica del menisco (figs. 5A y 5B).
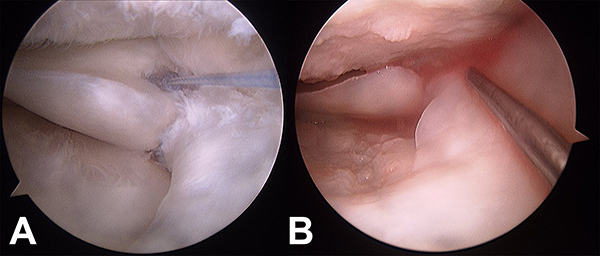
Figura 5A: Imagen artroscópica de rodilla izquierda desde el portal anterolateral que muestra la sutura meniscal todo-adentro en una lesión radial en zona 2-3 del cuerpo del menisco interno. Figura 5B: Imagen artroscópica con la rodilla seca, que muestra la infiltración con PRP en el sitio de la sutura meniscal.
En un estudio de Pujol y col.,65 sometieron a cincuenta y un pacientes jóvenes a reparación meniscal abierta; diecisiete de ellos recibieron una inyección adicional de PRP durante el procedimiento. Después de un año, se les realizó una resonancia magnética y se observaron cinco casos sin aumento de la señal dentro del menisco reparado (desgarro crónico) en el grupo con inyección de PRP, en contraste con ningún caso, como se describió anteriormente, en el grupo sin PRP. Después de un mínimo de dos años de seguimiento, se informaron mejores puntuaciones en las escalas KOOS e IKDC para el grupo de PRP.
Un estudio de Kaminski y col.66 mostró una mejora significativa en la tasa de cicatrización de lesiones meniscales verticales completas después de la artroscopía. La mejoría registrada de los meniscos reparados sin PRP fue del 47%, mientras que los tratados con PRP fue del 85%. De manera similar a los estudios previos, se observó una mejora significativa en las medidas de resultado informadas por el paciente (PROMs). Griffin y col.67 realizaron un análisis retrospectivo, con una segunda cirugía y el puntaje de Lysholm como los principales resultados analizados, con un mínimo de dos años de seguimiento. Los autores no mostraron ningún beneficio del aumento de PRP en el tratamiento de las lesiones meniscales.
Kemmochi y col.,68 en un estudio no aleatorio, incluyeron a veintidós pacientes con lesiones meniscales; diecisiete fueron sometidos a reparación de menisco con plasma rico en plaquetas y fibrina; cinco pacientes fueron asignados a un grupo de control con los meniscos simplemente suturados. Después de seis meses de seguimiento, se realizó una comparación de resonancias magnéticas pre y postoperatorias y evaluaciones funcionales (Tegner, Lysholm e IKDC): no hubo diferencias significativas entre ambos grupos en términos de PROMs, pero ambos evidenciaron una mejora gradual en la evaluación funcional. Las resonancias magnéticas tampoco indicaron mejoras significativas. De manera similar, un estudio reciente sobre la reparación artroscópica de la lesión del menisco externo discoide no demostró diferencias significativas en el alivio del dolor, la mejoría funcional o la tasa de fracaso entre los grupos en el seguimiento a medio plazo.69 Sin embargo, todos estos estudios fueron pequeños, con el riesgo de tener poco poder estadístico para todos los resultados. Además, el tipo de lesión y la ubicación diferían para cada uno de los estudios.
Everhart y col.70 realizaron un estudio en quinientos cincuenta pacientes sometidos a reparación meniscal, con administración de PRP, o sin esta; así como con reconstrucción del LCA, o sin esta reconstrucción. Las conclusiones, después de tres años, mostraron que la reparación meniscal con PRP (fallas del 14%) tiene mejores resultados que el mismo procedimiento realizado sin PRP (20% para reparaciones meniscales aisladas), pero no se registraron diferencias cuando la cirugía fue efectuada con una reconstrucción concomitante del LCA.
También se realizaron algunos estudios sobre lesiones meniscales crónicas. Blanke y col.71 revelaron que las inyecciones percutáneas de PRP fueron capaces de aliviar el dolor y detener la progresión de las lesiones meniscales en la RMI durante un período de seis meses. Un informe reciente de Betancourt y col.72 describió un resultado favorable del tratamiento con PRP en un paciente con lesión de menisco interno de grado 3 durante un seguimiento de treinta meses. Strümper y col.73 demostraron que la inyección intraarticular de PRP era una opción efectiva en el dolor de rodilla asociado con lesiones meniscales. El estudio reveló una función significativamente mejorada en el 83% de los pacientes. Además, la inyección concomitante de PRP redujo la necesidad de una futura artroscopía durante el período de observación de seis meses. No se advirtió progresión de las lesiones meniscales en la RM, medida por el Boston Leeds Osteoarthritis Knee Score.
Kaminski y col.56 llevaron a cabo un estudio prospectivo, aleatorio, doble ciego, de grupos paralelos, controlado con placebo, con setenta y dos pacientes que se sometieron a trepanación meniscal con inyección de PRP, o sin esta. Las fallas controladas por resonancia magnética / artroscopía de segundo examen fueron más raras en el grupo con inyección concomitante de PRP (70-48%), al igual que la necesidad de cirugía futura en el grupo tratado con PRP. En ambos grupos, la subescala KOOS, el puntaje IKDC y WOMAC mejoraron, pero los valores de VAS y síntomas KOOS que exceden la MCID (diferencia clínica mínimamente importante) se elevaron significativamente en el grupo PRP.
Microfracturas
Estimulación de la médula ósea
Se ha descripto el potencial de cicatrización durante la reparación meniscal con reconstrucción concomitante del LCA, donde los túneles de perforación en fémur y tibia también liberan médula ósea con células progenitoras y factores de crecimiento.74, 75 Un mecanismo potencial, que conduce a la regeneración y reparación del menisco lesionado, puede implicar la diferenciación de las MSC en el tejido deseado, la producción de factores de crecimiento y la fusión con las células de menisco.25
Los ensayos clínicos de Dean y col.74 han proporcionado evidencia de alta calidad para la eficacia de la estimulación de la médula ósea o microfracturas en el aumento de la tasa de curación meniscal después de la reparación. La tasa de fracaso fue similar entre la reparación meniscal con microfracturas (12.9%) y la reparación meniscal más la reconstrucción del LCA (7.8%). Kaminski y col.,76 en un estudio prospectivo, aleatorio, doble ciego, de grupos paralelos, controlados con placebo, y según lo evaluado por control artroscópico, respaldaron la hipótesis de que las microfracturas mejoran la cicatrización del menisco. Veinte pacientes fueron sometidos a reparación de menisco solo, mientras que otros veinte recibieron cirugía más microfracturas en el surco intercondíleo. En el grupo de microfracturas, cicatrizó el 100% de los meniscos, en comparación con el 76% en el de control. En ambos grupos, los pacientes mostraron una mejora en la puntuación del dolor (VAS y KOOS) sin diferencias significativas. Los resultados funcionales (IKDC, WOMAC, KOOS) fueron significativamente mejores en el grupo de microfracturas.
Terapias celulares
Los estudios clínicos que utilizan terapias celulares para la reparación meniscal son actualmente limitados. Vangsness y col.,77 en un estudio nivel 1 de evidencia, encontraron, en la resonancia magnética, un crecimiento de menisco estadísticamente significativo, doce meses después de la inyección, así como mejoras en los resultados clínicos y funcionales utilizando células mesenquimales de médula ósea alogénicas expandidas, inyectadas percutáneamente en las rodillas.
Pak y col.78 informaron sobre la reparación de una lesión meniscal de grado II después de una inyección percutánea de células del tejido adiposo autólogo (ASC) junto con PRP, ácido hialurónico y cloruro de CaCl2. El uso de células madre mesenquimales para estimular la regeneración del tejido meniscal parece ser un enfoque prometedor para restaurar la mayor cantidad posible de ese tejido. Sin embargo, estas tecnologías regenerativas aún necesitan ser optimizadas.
CONCLUSIONES
En la última década, ha aumentado exponencialmente el número de estudios de ciencias básicas y clínicos sobre terapias biológicas en artroscopía de rodilla. En su mayoría informaron perfiles de seguridad aceptables con resultados promisorios, pero heterogéneos. Se necesitarán estudios adicionales, randomizados, prospectivos, controlados y comparativos para determinar la eficacia real de las diferentes estrategias de aumento biológico en el entorno clínico. En este campo de rápido desarrollo, es imperativo que los cirujanos artroscopistas permanezcan actualizados en los avances en las técnicas artroscópicas y el uso, en evolución, de estas terapias para proporcionar la mejor atención a los pacientes.
BIBLIOGRAFÍA
1. AAOS O. Orthobiologics, 2010; consultado el 7 de mayo de 2020.
2. Nguyen RT; Borg-Stein J; McInnis K. Applications of platelet-rich plasma in musculoskeletal and sports medicine: an evidence-based approach. Pm R, 2011; 3(3): 226-50.
3. Zhu Y; et al. Basic science and clinical application of platelet-rich plasma for cartilage defects and osteoarthritis: a review. Osteoarthritis Cartilage, 2013; 21(11): 1627-37.
4. Boakye LA; et al. Platelet-rich plasma increases transforming growth factor-beta1 expression at graft-host interface following autologous osteochondral transplantation in a rabbit model. World J Orthop, 2015; 6(11): 961-9.
5. Wu CC; et al. Regenerative potentials of platelet-rich plasma enhanced by collagen in retrieving pro-inflammatory cytokine-inhibited chondrogenesis. Biomaterials, 2011; 32(25): 5847-54.
6. Fice MP; et al. The Role of Platelet-Rich Plasma in Cartilage Pathology: An Updated Systematic Review of the Basic Science Evidence. Arthroscopy, 2019; 35(3): 961-76.e3.
7. Re'em T; et al. Chondrogenesis of hMSC in affinity-bound TGF-beta scaffolds. Biomaterials, 2012; 33(3): 751-61.
8. Yin Z; et al. Platelet-rich plasma combined with agarose as a bioactive scaffold to enhance cartilage repair: an in vitro study. J Biomater Appl, 2014; 28(7): 1039-50.
9. Pereira RC; et al. Dual effect of platelet lysate on human articular cartilage: a maintenance of chondrogenic potential and a transient proinflammatory activity followed by an inflammation resolution. Tissue Eng Part A, 2013; 19(11-12): 1476-88.
10. Lee HR; et al. Platelet-rich plasma loaded hydrogel scaffold enhances chondrogenic differentiation and maturation with up-regulation of CB1 and CB2. J Control Release, 2012; 159(3): 332-7.
11. Dohan Ehrenfest DM; Rasmusson L; Albrektsson T. Classification of platelet concentrates: from pure platelet-rich plasma (P-PRP) to leucocyte- and platelet-rich fibrin (L-PRF). Trends Biotechnol, 2009; 27(3): 158-67.
12. Dohan Ehrenfest DM; et al. Do the fibrin architecture and leukocyte content influence the growth factor release of platelet concentrates? An evidence-based answer comparing a pure platelet-rich plasma (P-PRP) gel and a leukocyte- and platelet-rich fibrin (L-PRF). Curr Pharm Biotechnol, 2012; 13(7): 1145-52.
13. Mishra A; et al. Sports medicine applications of platelet rich plasma. Curr Pharm Biotechnol, 2012; 13(7): 1185-95.
14. Bielecki T; et al. The role of leukocytes from L-PRP/L-PRF in wound healing and immune defense: new perspectives. Curr Pharm Biotechnol, 2012; 13(7): 1153-62.
15. Cavallo C; et al. Comparison of platelet-rich plasma formulations for cartilage healing: an in vitro study. J Bone Joint Surg Am, 2014; 96(5): 423-9.
16. Moojen DJ; et al. Antimicrobial activity of platelet-leukocyte gel against Staphylococcus aureus. J Orthop Res, 2008; 26(3): 404-10.
17. Di Martino A; et al. Platelet-Rich Plasma Versus Hyaluronic Acid Injections for the Treatment of Knee Osteoarthritis: Results at 5 Years of a Double-Blind, Randomized Controlled Trial. Am J Sports Med, 2019; 47(2): 347-54.
18. Chahla J; et al. A Call for Standardization in Platelet-Rich Plasma Preparation Protocols and Composition Reporting: A Systematic Review of the Clinical Orthopaedic Literature. J Bone Joint Surg Am, 2017; 99(20): 1769-79.
19. Dominici M; et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy, 2006; 8(4): 315-7.
20. Caplan AI. Mesenchymal Stem Cells: Time to Change the Name! Stem Cells Transl Med, 2017; 6(6): 1445-51.
21. Chu CR; et al. Optimizing Clinical Use of Biologics in Orthopaedic Surgery: Consensus Recommendations from the 2018 AAOS/NIH U-13 Conference. J Am Acad Orthop Surg, 2019; 27(2): e50-e63.
22. Murray IR; et al. International Expert Consensus on a Cell Therapy Communication Tool: DOSES. J Bone Joint Surg Am, 2019; 101(10): 904-11.
23. Longo UG; et al. Biological strategies to enhance healing of the avascular area of the meniscus. Stem Cells Int, 2012; 2012: 528359.
24. Koch M; et al. Bone Marrow Aspirate Concentrate for the Treatment of Avascular Meniscus Tears in a One-Step Procedure-Evaluation of an In Vivo Model. Int J Mol Sci, 2019; 20(5).
25. Pak J; Lee JH; Lee SH. Regenerative repair of damaged meniscus with autologous adipose tissue-derived stem cells. Biomed Res Int, 2014; 2014: 436029.
26. Cassano JM; et al. Bone marrow concentrate and platelet-rich plasma differ in cell distribution and interleukin 1 receptor antagonist protein concentration. Knee Surg Sports Traumatol Arthrosc, 2018; 26(1): 333-42.
27. Hutchinson ID; et al. Can platelet-rich plasma enhance anterior cruciate ligament and meniscal repair? J Knee Surg, 2015; 28(1): 19-28.
28. Snyder TN; et al. A fibrin/hyaluronic acid hydrogel for the delivery of mesenchymal stem cells and potential for articular cartilage repair. J Biol Eng, 2014; 8: 10.
29. McNulty AL; Guilak F. Mechanobiology of the meniscus. J Biomech, 2015; 48(8): 1469-78.
30. Infante A; et al. Platelet Rich Plasma and Culture Configuration Affect the Matrix Forming Phenotype of Bone Marrow Stromal Cells. Tissue Eng Regen Med, 2017; 14(5): 567-77.
31. van Buul GM; et al. Platelet-rich plasma releasate inhibits inflammatory processes in osteoarthritic chondrocytes. Am J Sports Med, 2011; 39(11): 2362-70.
32. Cugat R; et al. Treatment of Knee Osteochondral Lesions Using a Novel Clot of Autologous Plasma Rich in Growth Factors Mixed with Healthy Hyaline Cartilage Chips and Intra-Articular Injection of PRGF. Case Rep Orthop, 2017; 2017: 8284548.
33. Cugat R; et al. A novel autologous-made matrix using hyaline cartilage chips and platelet-rich growth factors for the treatment of full-thickness cartilage or osteochondral defects: Preliminary results. J Orthop Surg (Hong Kong), 2020; 28(1): 2309499019887547.
34. Domínguez Pérez JM; et al. Cartilage regeneration using a novel autologous growth factors-based matrix for full-thickness defects in sheep. Knee Surg Sports Traumatol Arthrosc, 2019; 27(3): 950-61.
35. Gobbi A; Whyte GP. Long-term Clinical Outcomes of One-Stage Cartilage Repair in the Knee With Hyaluronic Acid-Based Scaffold Embedded With Mesenchymal Stem Cells Sourced From Bone Marrow Aspirate Concentrate. Am J Sports Med, 2019; 47(7): 1621-8.
36. Gobbi A; Dallo I; Kumar V. Editorial Commentary: Biological Cartilage Repair Technique-An "Effective, Accessible, and Safe" Surgical Solution for an Old Difficult Biological Problem. Arthroscopy, 2020; 36(3): 859-61.
37. Caplan AI; Correa D. The MSC: an injury drugstore. Cell Stem Cell, 2011; 9(1): 11-5.
38. Krych AJ; et al. Bone Marrow Concentrate Improves Early Cartilage Phase Maturation of a Scaffold Plug in the Knee: A Comparative Magnetic Resonance Imaging Analysis to Platelet-Rich Plasma and Control. Am J Sports Med, 2016; 44(1): 91-8.
39. Costa Paz M; et al. Spontaneous healing in complete ACL ruptures: a clinical and MRI study. Clin Orthop Relat Res, 2012; 470(4): 979-85.
40. Seijas R; et al. Partial anterior cruciate ligament tears treated with intraligamentary plasma rich in growth factors. World J Orthop, 2014; 5(3): 373-8.
41. Centeno CJ; et al. Anterior cruciate ligament tears treated with percutaneous injection of autologous bone marrow nucleated cells: a case series. J Pain Res, 2015; 8: 437-47.
42. Dallo I. Aumentación Biológica Intra-operatoria en Lesiones Parciales del LCA. Serie de Casos, Técnica y Resultados. Revista de la Asociación Argentina de Traumatología del Deporte, 2017.
43. Gobbi A; Whyte GP. Long-term Outcomes of Primary Repair of the Anterior Cruciate Ligament Combined With Biologic Healing Augmentation to Treat Incomplete Tears. Am J Sports Med, 2018; 46(14): 3368-77.
44. Dallo I; et al. Biologic Approaches for the Treatment of Partial Tears of the Anterior Cruciate Ligament: A Current Concepts Review. Orthop J Sports Med, 2017; 5(1): 2325967116681724.
45. GP.Whyte, I Dallo; K. Herman; A. Gobbi. “Future Trends in Ligament Surgery”. En ISAKOS Book Complex Knee Ligament Injuries, Springer, 2019, pp. 201-9.
46. Figueroa D; et al. Platelet-rich plasma use in anterior cruciate ligament surgery: systematic review of the literature. Arthroscopy, 2015; 31(5): 981-8.
47. Komatsu DE; et al. The In Vivo Impact of Leukocyte Injections on Normal Rat Achilles Tendons: Potential Detriment to Tendon Morphology, Cellularity, and Vascularity. Am J Orthop (Belle Mead, NJ), 2018, 47(10).
48. Magnussen RA; et al. Platelet rich plasma use in allograft ACL reconstructions: two-year clinical results of a MOON cohort study. Knee, 2013; 20(4): 277-80.
49. Sanchez M; et al. Ligamentization of tendon grafts treated with an endogenous preparation rich in growth factors: gross morphology and histology. Arthroscopy, 2010; 26(4): 470-80.
50. Mirzatolooei F; Alamdari MT; Khalkhali HR. The impact of platelet-rich plasma on the prevention of tunnel widening in anterior cruciate ligament reconstruction using quadrupled autologous hamstring tendon: a randomised clinical trial. Bone Joint J, 2013; 95-b(1): 65-9.
51. Vogrin M; et al. The effect of platelet-derived growth factors on knee stability after anterior cruciate ligament reconstruction: a prospective randomized clinical study. Wien Klin Wochenschr, 2010; 122 Suppl 2: 91-5.
52. Vadala A; et al. Platelet-rich plasma: does it help reduce tunnel widening after ACL reconstruction? Knee Surg Sports Traumatol Arthrosc, 2013; 21(4): 824-9.
53. Rupreht M; Vogrin M; Hussein M. MRI evaluation of tibial tunnel wall cortical bone formation after platelet-rich plasma applied during anterior cruciate ligament reconstruction. Radiol Oncol, 2013; 47(2): 119-24.
54. Marui T; et al. Effect of growth factors on matrix synthesis by ligament fibroblasts. J Orthop Res, 1997; 15(1): 18-23.
55. Di Matteo B; et al. Biologic agents for anterior cruciate ligament healing: A systematic review. World J Orthop, 2016; 7(9): 592-603.
56. Kaminski R; et al. Short-Term Outcomes of Percutaneous Trephination with a Platelet Rich Plasma Intrameniscal Injection for the Repair of Degenerative Meniscal Lesions. A Prospective, Randomized, Double-Blind, Parallel-Group, Placebo-Controlled Study. Int J Mol Sci, 2019; 20(4).
57. Uchio Y; et al. Results of rasping of meniscal tears with and without anterior cruciate ligament injury as evaluated by second-look arthroscopy. Arthroscopy, 2003; 19(5): 463-9.
58. Chirichella PS; et al. Treatment of Knee Meniscus Pathology: Rehabilitation, Surgery, and Orthobiologics. Pm R, 2019; 11(3): 292-308.
59. Arnoczky SP; Warren RF. The microvasculature of the meniscus and its response to injury. An experimental study in the dog. Am J Sports Med, 1983; 11(3): 131-41.
60. Gao JZ. Experimental study on healing of old tear in the avascular portion of menisci in dogs. Zhonghua Wai Ke Za Zhi, 1990; 28(12): 726-9, 782.
61. Fox JM; Rintz KG; Ferkel RD. Trephination of incomplete meniscal tears. Arthroscopy, 1993; 9(4): 451-5.
62. Henning CE; Lynch MA; Clark JR. Vascularity for healing of meniscus repairs. Arthroscopy, 1987; 3(1): 13-8.
63. Shelbourne KD; Gray T. Meniscus tears that can be left in situ, with or without trephination or synovial abrasion to stimulate healing. Sports Med Arthrosc Rev, 2012; 20(2): 62-7.
64. Chahla J; et al. Meniscal Repair with Fibrin Clot Augmentation. Arthrosc Tech, 2017; 6(6): e2065-e2069.
65. Pujol N; et al. Long-term outcomes of all-inside meniscal repair. Knee Surg Sports Traumatol Arthrosc, 2015; 23(1): 219-24.
66. Kaminski R; et al. A Prospective, Randomized, Double-Blind, Parallel-Group, Placebo-Controlled Study Evaluating Meniscal Healing, Clinical Outcomes, and Safety in Patients Undergoing Meniscal Repair of Unstable, Complete Vertical Meniscal Tears (Bucket Handle) Augmented with Platelet-Rich Plasma. Biomed Res Int, 2018; 2018: 9315815.
67. Griffin JW; et al. Platelet-rich plasma in meniscal repair: does augmentation improve surgical outcomes? Clin Orthop Relat Res, 2015; 473(5): 1665-72.
68. Kemmochi M; et al. The use of platelet-rich fibrin with platelet-rich plasma support meniscal repair surgery. J Orthop, 2018; 15(2): 711-20.
69. Dai WL; et al. Efficacy of platelet-rich plasma in arthroscopic repair for discoid lateral meniscus tears. BMC Musculoskelet Disord, 2019; 20(1): 113.
70. Everhart JS; et al. Platelet-Rich Plasma Reduces Failure Risk for Isolated Meniscal Repairs but Provides No Benefit for Meniscal Repairs with Anterior Cruciate Ligament Reconstruction. Am J Sports Med, 2019; 47(8): 1789-96.
71. Blanke F; et al. Percutaneous injections of Platelet rich plasma for treatment of intrasubstance meniscal lesions. Muscles Ligaments Tendons J, 2015; 5(3): 162-6.
72. Betancourt JP; Murrell WD. Leukocyte-poor platelet-rich plasma to treat degenerative meniscal tear: A case report. J Clin Orthop Trauma, 2016; 7(Suppl 1): 106-9.
73. Strumper R. Intra-Articular Injections of Autologous Conditioned Serum to Treat Pain from Meniscal Lesions. Sports Med Int Open, 2017; 1(6): e200-e205.
74. Dean CS; et al. Outcomes After Biologically Augmented Isolated Meniscal Repair With Marrow Venting Are Comparable With Those After Meniscal Repair With Concomitant Anterior Cruciate Ligament Reconstruction. Am J Sports Med, 2017; 45(6): 1341-8.
75. Driscoll MD; et al. Marrow stimulation improves meniscal healing at early endpoints in a rabbit meniscal injury model. Arthroscopy, 2013; 29(1): 113-21.
76. Kaminski R; et al. Repair Augmentation of Unstable, Complete Vertical Meniscal Tears With Bone Marrow Venting Procedure: A Prospective, Randomized, Double-Blind, Parallel-Group, Placebo-Controlled Study. Arthroscopy, 2019; 35(5): 1500-8.e1.
77. Vangsness CT Jr; et al. Adult human mesenchymal stem cells delivered via intra-articular injection to the knee following partial medial meniscectomy: a randomized, double-blind, controlled study. J Bone Joint Surg Am, 2014; 96(2): 90-8.
78. Pak J; et al. Safety reporting on implantation of autologous adipose tissue-derived stem cells with platelet-rich plasma into human articular joints. BMC Musculoskelet Disord, 2013; 14: 337.